480 руб. | 150 грн. | 7,5 долл. ", MOUSEOFF, FGCOLOR, "#FFFFCC",BGCOLOR, "#393939");" onMouseOut="return nd();"> Диссертация - 480 руб., доставка 10 минут , круглосуточно, без выходных и праздников
Ефимов Григорий Александрович. Новые генно-инженерные белки на основе рекомбинантных антител против TNF: диссертация... кандидата биологических наук: 03.01.03 / Ефимов Григорий Александрович;[Место защиты: Институт молекулярной биологии им.В.А.Энгельгарда РАН].- Москва, 2015.- 122 с.
Введение
Обзор литературы 9
1. История открытия tnf 9
2. Суперсемейство tnf 10
3. Структура системы tnfnfr 12
4. Функции tnf 15
5. Роль TNF в патогенезе ревматоидного артрита и других аутоиммунных заболеваний 16
6. Терапевтическая блокировка tnf 18
7. Побочные эффекты и ограничения антиnf терапии 23
8. Новые подходы и перспективы tnf блокировки 25
Материалы и методы исследования 29
1. Получение и характеристика нового верблюжьего одно доменного антитела к tnf человека 29
Экспрессия и очистка однодоменного антитела Vhh41 29
Оценка связывания антитела Vhh41 с TNF человека методом ИФА 30
Изучение взаимодействия Vhh41 и TNF человека методом поверхностного плазменного резонанса 31
Исследования способности Vhh41 блокировать TNF человека 31
2. Конструирование, получение и характеристика гибридных белков флуоресцентных сенсоров TNF 32
Конструирование генов, кодирующих сенсоры TNF. 32
Экспрессия и очистка флуоресцентных сенсоров TNF. 33
Анализ взаимодействия Vhh41-K с рекомбинантным TNF. 34
Исследование биологических свойств флуоресцентного сенсора Vhh41-KTNFin vitro и in vivo . З5
Изучение способности флуоресцентного сенсора связывать TNF in vivo 36
Прижизненное изучение экспрессии TNF с помощью полученного флуоресцентного сенсора...39
3. Получение и характеристика одноцепочечного АНТИNF антитела 40
Изучение мышиного моноклонального антитела F10 40
Конструирование и экспрессия одноцепочечного антитела ahT-4 41
Измерение биологической активности одноцепочечного антитела ahT-4 42
4. Получение и характеристика химерного антиnf антитела 43
5. Конструирование, получение и характеристика биспецифических антител А9 и МА9 43
Конструирование, экспрессия и очистка антител А9 и тА9 43 Взаимодействие антител А9 и тА9 с рекомбинантным TNF человека методом
поверхностного плазменного резонанса 44
Цитотоксический тест 45
Цитофлуориметрия 45
Оценка способности биспецифического антитела А9удерживать TNF человека на
поверхности макрофагов 45
6. Сравнительная оценка эффективности системной и селективной блокировки макрофагального TNF 46
Модель острой гепатотоксичности, индуцированной введением JIIJC/D-галактозамина 46
Результаты и обсуждение 48
1. Получение и характеристика нового рекомбинантного одно доменного антитела, специфически связывающегося с TNF человека, но не блокирующего его биологическую активность 50
Создание генетической конструкции, кодирующей рекомбинантное однодоменное антитело
Экспрессия и очистка рекомбинантного однодоменного антитела Vhh41 52
Анализ взаимодействия однодоменного антитела Vhh41 с TNF человека 53
Анализ способности антитела Vhh41 блокировать биологическую активность TNF человека.54
2. Конструирование, получение и характеристика молекулярных сенсоров TNF для прижизненного изучения экспрессии tnf на основе одно доменных рекомбинантных антител и красного флуоресцентного белка 56
Получение генетических конструкций, кодирующих флуоресцентный сенсор TNF Vhh41-Ku
контрольные гибридные белки 56
Экспрессия и очистка флуоресцентного сенсора TNF Vhh41-K. 57
Анализ взаимодействия флуоресцентного сенсора TNF Vhh41-К с рекомбинантным TNFмыши
и человека 58
Исследование биологических свойств флуоресцентного сенсора TNF Vhh41-Kin vitro и in vivo. 61
Изучение способности флуоресцентного сенсора связывать TNF in vivo 66
Прижизненное изучение экспрессии TNFс помощью полученного флуоресцентного сенсора... 69
3. Получение и характеристика рекомбинантного одноцепочечного антитела, блокирующего биологическую активность TNF 72
Измерение активности мышиного моноклонального антитела F10 72
Конструирование одноцепочечного антитела на базе вариабельных фрагментов легкой и
тяжелой цепей мышиного моноклонального антитела F 10 74
Измерение активности одноцепочечного антитела ahT-4 75
4. Разработка и анализ химерного антитела против TNF человека
Сравнение кинетики взаимодействий химерного антитела 13239 и инфликсимаба с
рекомбинантным TNF человека 77 Сравнение нейтрализующей активности химерного антитела 13239 с активностью
инфликсимаба in vitro 79
Анализ активности химерного антитела 13239 in vivo 80
5. Конструирование, получение и характеристика селективного б локатора tnf, производимого клетками моноцитарно-макрофагального ряда 82
Молекулярное клонирование, экспрессия и очистка биспецифических антител 82
Взаимодействие антител А9 и тА9 срекомбинантным TNF человека 86
Блокировка антителами А9 и тА9 TNF-зависимой цитотоксичности in vitro 87
Анализ связывания антител А9 и тА9 с поверхностью макрофагов через взаимодействие с
поверхностной молекулой F4/80 89
Удержание эндогенно продуцируемого TNF человека на поверхности макрофагов
биспецифическим антителом А9 93
6. Физиологически значимая селективная блокировка tnf, производимого клетками моноцитарно-макрофагального ряда in vivo 96
Сравнительная оценка эффективности направленной блокировки TNF, производимого клетками моноцитарно-макрофагалъного ряда, и системной блокировки TNF в модели острой
гепатотоксичности 96
Заключение 99
Список литературы 100
Роль TNF в патогенезе ревматоидного артрита и других аутоиммунных заболеваний
Первый опыт антицитокиновой терапии был осуществлен в 1985 г., когда мышам была введена поликлональная антиNF кроличья сыворотка, что предотвратило развитие у них летальной гепатотоксичности, индуцированной введением ЛПС . Аналогичные результаты были получены на обезьянах: павианы, которым вводилось моноклональное мышиное антитело против TNF человека, выжили, после внутривенной инъекции летальной дозы Е. coli [ 104].
Первый терапевтический блокатор TNF был разработан на основе высокоаффинного мышиного моноклонального антитела А2, полученного из мышей, иммунизированных TNF человека . Поскольку антитела других видов имеют существенные отличия в аминокислотной последовательности, они непригодны для долговременного терапевтического использования в людях. Поэтому методами генной инженерии мышиные константные домены тяжелой и легкой цепей были заменены на человеческие. Вариабельные участки, связывающие антиген, при этом остались неизмененными . Подобные антитела называются химерными. Впоследствии это первое терапевтическое антитело против TNF получило международное непатентованное название - инфликсимаб.
Одной из наиболее очевидных областей применения антиNF терапии было лечение сепсиса. Однако клинические исследования не показали значительных результатов , что, по всей видимости, связанно с тем, что к моменту развития клинической картины сепсиса необратимые сигнальные каскады уже запущены.
К этому моменту было накоплено уже много фактов, говорящих об участии TNF в патогенезе ревматоидного артрита, поэтому это заболевание было выбрано в качестве следующей потенциальной мишени для антиNF терапии. Пилотные исследования инфликсимаба в ревматоидном артрите дали многообещающие результаты , а дальнейшее рандомизированное двойное слепое исследование подтвердило эффективность антиNF терапии в терапии аутоиммунных заболеваний . Однако после повторных инъекций у некоторых пациентов вырабатывались антитела, специфичные к мышиным аминокислотным последовательностям в вариабельных доменах, что снижало эффективность терапии.
Двойное слепое рандомизированное исследование показало, что инфликсимаб обладает синергическим эффектом с небольшими дозами метотрексата -цитостатического препарата, использующегося для монотерапии РА. В сочетании эти два препарата обладают большей эффективностью, а иммуногенность инфликсимаба снижается . Последовавшие II/III фазы клинических испытаний привели к одобрению инфликсимаба для терапии РА .
Механизм действия инфликсимаба обусловлен, в основном, связыванием растворимого TNF в системном кровотоке и в местах локальной гиперэкспрессии (синовиальная полость при РА). Но, кроме того, инфликсимаб способен связываться с трансмембранной формой TNF и вызывать лизис клеток, несущих его на своей поверхности через механизм антитело-зависимой цитотоксичности .
АнтиNF терапия разрывает патологический сигнальный каскад и приводит к снижению воспалительной реакции, но, кроме того, она способна сбалансировать дисрегулированную иммунную систему. На фоне введения ингибиторов TNF сдвигается баланс Т-эффекторных и Т-регуляторных клеток .
АнтиNF терапия не является этиотропной терапией и теоретически должна применяться в течение всей жизни больного, однако в некоторых случаях удается добиться стойкой ремиссии, которая сохраняется и после отмены антиNF терапии .
Блокаторы TNF показали свою эффективность и при терапии других аутоиммунных и воспалительных заболеваний: было показано, что TNF играет значимую роль в патогенезе болезни Крона - он сверхэкспрессируется в воспаленных участках кишечника . Предварительные успехи в терапии болезни Крона, резистистентной к стандартной терапии, с помощью инфликсимаба позднее подтвердились в рандомизированных клинических испытаниях в результате чего инфликсимаб был одобрен для терапии и этого заболевания.
Патогенез анкилозирующего спондилита (болезни Бехтерева), еще одного хронического системного аутоиммунного заболевания с преимущественным поражением суставов, также обусловлен сверхэкспрессией TNF. Клинические испытания инфликсимаба оказались успешными и для этого заболевания . Кроме того, антиNF терапия показала высокую эффективность в лечении псориаза и псориатического артрита .
На сегодняшний момент инфликсимаб и другие блокаторы TNF утверждены в качестве терапевтических агентов для следующих аутоиммунных заболеваний: ревматоидный артрит, ювенильный идиопатический артрит, анкилозирующий спондилит, болезнь Крона, язвенный колит, псориаз, псориатический артрит. Кроме этого, антагонисты TNF показали положительные результаты в терапии саркоидоза , гранулематоза Вегенера , болезни Бехчета и других хронических заболеваний.
Указания на то, что TNF играет роль в патогенезе рассеянного склероза , были подтверждены экспериментами на лабораторных животных. Введение TNF усиливало симптоматику экспериментального аутоиммунного энцефаломиелита у крыс , а введение антиNF антитела предотвращало развитие этого заболевания .
Однако клинические исследования по терапии рассеянного склероза инфликсимабом и еще одним блокатором TNF - ленерцептом (растворимый TNFR1) не дали значимого клинического ответа . Более того, у некоторых пациентов
Модельное аутоиммунное заболевание, патогенез которого сходен с патогенезом множественного склероза. наблюдалось усиление клинических симптомов заболевания и увеличение клеточности и уровня иммуноглобулинов в спинномозговой жидкости, увеличение количества очагов при магнитно-резонансном исследовании .
Успех применения инфликсимаба дал толчок к созданию новых молекул, способных блокировать передачу сигнала через TNFR. Кроме того, мышиные последовательности в вариабельных доменах тяжелой и легкой цепи инфликсимаба вызывали у части пациентов продукцию вторичных антител, которые блокировали действие инфликсимаба и делали больных невосприимчивыми к терапии. Чтобы преодолеть это ограничение, был выбран путь создания ингибиторов с полностью человеческими аминокислотными последовательностями.
На сегодняшний день, кроме инфликсимаба, для клинического применения одобрены четыре антагониста TNF (см. Рис. 2):
Этанерцепт - рекомбинантный ингибитор TNF, сконструированный на основе растворимого TNFR2. В основу его разработки легли данные о том, что в организме человека присутствует растворимая форма второго рецептора TNF . «Слущиваемый» под действием металлопротеаз TNFR2 является дополнительным звеном регуляции активности TNF . Этанерцепт представляет собой димер внеклеточной части TNFR2, генетически слитый с Fc-фрагментом иммуноглобулина IgGl. Соединение с константным участком антитела существенно увеличивает период полужизни препарата в системном кровотоке за счет рециркуляции белка через FcRn рецептор . Нейтрализующая активность гибридного белка была продемонстрирована как в in vitro, так и в in vivo опытах , а позже подтверждена в клинических испытаниях на пациентах, страдающих ревматоидным артритом .
Однако при терапии воспалительных заболеваний кишечника этанерцепт, в отличии от инфликсимаба, не показал терапевтической эффективности . Экспериментальный блокатор TNF онерцепт, полученный на основе другого рецептора TNF - TNFR1 (р55), несмотря на обнадеживающие пилотные клинические исследования в рандомизированном плацебо-контролируемом двойном слепом исследовании, также не показал эффективности в терапии болезни Крона . Исследования in vitro, в котором изучались Т-лимфоциты из собственной пластинки слизистой больных, страдающих болезнью Крона, показали, что тогда как и инфликсимаб, и этанерцепт блокируют TNF, только инфликсимаб связывается с Т-клетками в очаге поражения и индуцирует в них апоптоз . Этим может объясняться различие эффективности блокаторов на основе антител и рекомбинантных рецепторов в воспалительных заболеваниях кишечника.
Изучение взаимодействия Vhh41 и TNF человека методом поверхностного плазменного резонанса
Генетическая конструкция, кодирующая биспецифическое антитело А9 была собрана ГЩР реакцией с 4 праймерами аналогичной, описанной выше для гена одноцепочечного антитела ahT-4. Получившаяся в результате последовательность состояла из: гена однодоменного антиNF антитела , затем последовательности, кодирующей линкер вида (Gly4Ser)3, и гена одноцепочечного анти-Р4/80 антитела (любезно предоставлен С.Гордоном и М.Стейси). Сайты узнавания рестриктаз Ncol и Xhol были включены в последовательность прямого и обратных праймеров соответственно. После рестрикции ПЦР продукта и клонирования его в экспрессионный вектор pET-28b (Novagen) последовательность, кодирующая полигексидиновую метку оказалась на 3 конце в той же рамке считывания. Для получения контрольного антитела шА9 мутантный ген анти-Г4/80 scFv, содержащий вместо CDR последовательностей глицин-сериновые вставки был синтезирован de-novo (Geneart, Германия) и клонирован вместо нативного гена анти-F4/80 (см. Рис. 31В).
Экспрессионные вектора, несущие вставки, кодирующие А9 и шА9 были использованы для трансформации клеток Е.coli штамма Rosetta2(DE3)pLysS (Novagen). Лучшие клоны продуценты были отобраны методом иммуноблотинга колоний с использованием никель-конъюгированной пероксидазы (Pierce, 15165). Бактериальные культуры наращивались в среде LB, содержащей 50 цг/мл карбенициллина (Sigma -С1389) и 50 цг/мл хлорамфеникола (Sigma - С1863) до логарифмической фазы, а затем экспрессия индуцировалась 0.2 мМ ИПТГ. Через 4 часа культуры подвергались центрифугированию при 3200 g в течение 30 мин. Осадки замораживались а затем ресуспензировась в лизирующем буфере (50 мМ TrisHCl, 300 MMNaCl, 5% глицерин, 0.5% детергента Triton Х-100, 10000 Ед/мл лизоцим, 10 мМ Р-меркаптоэтанол) а потом разрушались с помощью утразвукового гомогенизатора. Лизаты центрифугировались при 17000 g в течение 40 мин., супернатанты отбирали и фильтровали через фильтр с диаметром пор 0,22 цм. БиспецифическЫ антитела А9 и тА9 очищались из просветленных супернатантов на хроматографической колонке, содержащей агарозу, конъюгированную с Ni-нитрилоуксусной кислотой (Invitrogen R90115). Аффинную хроматографию проводили по протоколу производителя. Полученный элюат концентрировали, диализовали против фосфатно-солевого буфера, с последующей фильтрацией через фильтр 0.22 мкм. Концентрация белка в растворе измерялась с помощью реакции с 2,2 -бицинхониновой кислотой (набор PIERCE 23225) по протоколу фирмы производителя. Гомогенность полученного препарата была проверена методом электрофореза в 15% полиакриламидном геле в присутствии додецилсульфата натрия с последующей окраской кумасси.
Взаимодействие антител А9 и тА9 с рекомбинантным TNF человека методом поверхностного плазмонного резонанса.
Сравнение аффинностей и кинетик взаимодействия антител А9 и шА9 с рекомбинантным TNF человека проводилось на приборе ProteOn XPR36 (Bio-Rad). В ходе измерения всех взаимодействий использовался фосфатно-солевой буфер, имеющий рН=7,4, в который был добавлен детергент Tween 20 до концентрации 0,005%, температура поверхности чипа составляла 25 С. Рекомбинантный TNF человека был экспрессирован в Е. coli по описанной ранее методике . Антитела А9 и тА9 в концентрации 50 нМ иммобилиз провались через амино-группу на поверхности биочипа с модифицированной альгинатной полимерной поверхностью (Bio-Rad 176-5011). Затем аналит (TNF человека) в пяти двукратно убывающих концентрациях (50 -3 нМ) наносились в пять параллельных каналов. В шестой канал вводился буфер, не содержащий антитела, для нормировки. Анализ полученных сенсограмм проводился в программе ProteOn Manager (Bio-Rad) с использованием модели Ленгмюра.
В экспериментах с перитонеальными макрофагами клетки перитонеальной полости выделялись из мышей дикого типа (C57BL/6) и сразу же окрашивались с использованием антител, коъюгированных с флуорохромами. Для получения костномозговых макрофагов костный мозг выделялся, после чего клетки культивировались в течение 10 дней в кондиционный среде (полученной на линии L929), затем клетки снимались с пластика ледяным фосфатным буфером.
Перед окрашиванием Fc-гамма рецептор блокировался, затем клетки инкубировались с антителами А9 или тА9 или буфером, после чего клетки отмывались и окрашивались одним из трех способов: 1) поликлональными кроличьими антителами к hTNF-VnH, затем со вторичными антителами к IgG кролика, конъюгированными с флуорохромом. 2) моноклональными мышиными антителами к гексагистидиновой последовательность (Novagen - 70796), затем со вторичными антителами к IgG мыши, конъюгированными с флуорохромом. 3) к клеткам добавлялся рекомбинантный TNF человека, а затем моноклональные антиNF антитела (Miltenyi Biotec - clone: сА2), меченные флуорохромом.
Кроме того клетки окрашивались анти-Р4/80 и анти-CD 1 lb антителами, конъюгированными с флуорохромами. Образцы анализировались либо на приборе F ACS Aria (BDBiosciences) или Guava EasyCyte 8HT (Millipore) а затем полученные данные обрабатывались с помощью программы FlowJo (Treestar Inc.).
Оценка способности биспецифического антитела А9 удерживать TNF человека на поверхности макрофагов.
Перитонеальные макрофаги из мышей, продуцирующих TNF человека, выделялись и рассаживались в количестве 100 тыс. клеток на лунку в 96-луночные культуральные планшеты. Клетки инкубировались в течение 2 ч при 37С, 5%СОг, после чего не прикрепившиеся клетки смывались теплым фосфатным буфером. Затем клетки икубировались в течение ночи при 37С, 5% СОг. После промывки 200 мкл теплой среды DMEM клетки инкубировались с антителами А9 в концентрации 2мкг/мл или со средой DMEM 30 минут при 37С. После еще одной промывки клетки стимулировались ЛПС (Sigma, L2630) в концентрации 100 нг/мл. Через 4 ч культуральные супернатанты собирались и концентрация TNF человека измерялась с помощью набора для ИФА (eBioscience, 88-7346) по протоколу производителя.
Костный мозг из мышей, продуцирующих TNF человека выделялся, после чего клетки культивировались в течение 10 дней в кондиционный среде (полученной на линии L929), затем клетки снимались с пластика ледяным фосфатным буфером. Количество живых клеток подсчитывалось и они рассаживались на 96 луночные планшеты в концентрации 50000 клеток/лунку. Затем к клеткам добавлялось 250 цМ антитела А9 или однодоменного антитела hTNF-VffH или пустая среда (DMEM). Клетки инкубировались с антителами в течение 30 мин. Затем лунки промывались фосфатно-солевым буфером. После этого продукция TNF стимулировалась ЛПС (Sigma - L2630) в концентрации 100 нг/мл. Через 4 часа супернатанты собирались, концентрация TNF в них измерялась с помощью цитотоксического теста на линии мышиной фибросаркомы L929 по протоколу аналогичному описанному выше.
Исследование биологических свойств флуоресцентного сенсора Vhh41-KTNFin vitro и in vivo
На основании экспериментальных данных, полученных на линиях мышей, в которых ген Tnf удален в отдельных клеточных популяциях , была сформулирована гипотеза о возможных различных функциях TNF, производимого разными типами иммуноцитов. Так недавно было показано, что в модели экспериментальной туберкулезной инфекции TNF, продуцируемый Т-лимфоцитами, но не миелоидными клетками, имеет уникальную защитную функцию . Кроме того в нашей лаборатории получены данные, указывающие на патогенные свойства TNF из миелоидных клеток при аутоиммунных заболеваниях . Терапевтически применяемая полная блокировка ПМБне учитывает этих особенностей. В рамках развития данной гипотезы было выбрано специфическое ингибирование TNF, производимого клетками моноцитарно-макрофагального ряда, которое могло бы иметь существенное преимущество перед системной блокировкой этого цитокина. В частности, интактный сигнал от TNF, производимого В- и Т- лимфоцитами, мог бы снизить частоту побочных эффектов, а, кроме того, сделать антиNF терапию эффективной в тех болезнях, для которых ранее блокаторы TNF не показали клинической эффективности, или даже вызывали усиление симптоматики. Кроме того, такой подход может потенциально снизить необходимую дозу за счет адресной доставки к клеткам-продуцентам.
Для проверки этого предположения мы сконструировали и испытали биспецифическое антитело, которое одной своей частью связывается с поверхностью макрофагов за счет взаимодейсвия с трансмембранной молекулой F4/80, а второй специфичностью захватывает и блокирует производимый ими TNF.
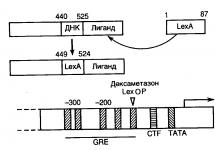
Молекулярное клонирование, экспрессия и очистка биспецифических антител. Биспецифическое антитело - селективный блокатор макрофагального TNF -получило название А9. Для создания кодирующей его генетической конструкции были использованы однодоменное блокирующего антиNF антитело hTNF-VffH и одноцепочечное антитело (scFv) против макрофагального поверхностного маркера F4/80 (любезно предоставленное С. Гордоном (Оксфордский университет, Великобритания) и М. Стейси (университет Лидса, Великобритания). Последовательности, кодирующие оба антитела были амплифицированы с помощью полимеразной цепной реакции (ПЦР) и клонированы в экспрессионный вектор таким образом, что они оказались в одной рамке считывания, а между ними образовалась нуклеотидная последовательность, кодирующая гибкий глицин-сериновый линкер (GSGGGGSG). На С-конце последовательности располагается последовательность, кодирующая гистидиновый гексамер, для последующей очистки белка (Рис. 31).
Дизайн биспецифического антитела А9, схематическое изображение его механизма действия, строение генетических конструкций, кодирующих биспецифическое антитело А9 и контрольный системный блокатор TNF -антитело тА9. (А) Биспецифическое антитело А9 состоит из однодоменного антитела (VHH) против TNF человека и одноцепочечного антитела (scFv) против поверхностной молекулы F4/80, экспрессирующейся на моноцитах и макрофагах. (Б) Принцип селективной блокировки TNF, производимого макрофагами: А9 связывется с поверхностью макрофагагов и захватывает высвобождаемый с их поверхности TNF, предотвращая его попадание в системную циркуляцию. (В) Схема генетической конструкции биспецифического антитела А9 и контрольного системного блокатора TNF - тА9. Ген однодоменного антиNF антитела сопровождается последовательностью, кодирующей гибкий глицин-сериновый линкер, а затем геном одноцепочечного антитела против F4/80. Затем следует последовательность, кодирующая гистидиновый гексамер для аффинной очистки. Контрольное антитело тА9 имеет аналогичную последовательность за исключением того, что 6 гипевариабельных участков анти-Р4/80 антитела заменены на последовательности вида (Gly3Ser)n, что препятствует связыванию антитела с поверхностью макрофагов и превращает его в системный ингибитор TNF.
Для изучения эффектов специфической блокировки TNF, производимого макрофагами, был необходим контрольный системный блокатор. Чтобы избежать эффектов связанных с различиями в аффинности антител, было решено использовать блокатор имеющий аналогичный А9 TNF-связывающий участок. А для того, чтобы исключить влияние других факторов, в частности изоэлектрической точки и молекулярной массы, которая может влиять на время полувыведения, контрольное антитело должно быть максимально приближено по первичной аминокислотной последовательности к изучаемому. Поэтому нами было сконструировано контрольное антитело - тА9, имеющее ту же структуру и аминокислотную последовательность, что и А9 за исключением того, что 6 его гипервариабельных участков в анти-Р4/80 scFv заменены на последовательности вида (Gly3Ser)n, той же длины, что исходные CDR участки (см. Рис. 31 В).
Оба антитела были экспрессированы в бактериальной системе и очищены методом аффинной хроматографии.
Размер антитела А9, определенный по электрофоретической подвижности и по данным ВЖЕХ, соответствовал расчетной молекулярной массе - 45 кДА (Рис. 32). хроматографии. Слева - значения молекуляного веса белков. (Б) Хроматограмма биспецифического антитела А9 (отмечена красным цветом), наложенная на хроматограмму маркеров молекулярной массы. (В) Функция зависимости времени прохождения молекулы в зависимости от молекулярной массы. Расчетная молекулярная масса биспецифического антитела А9 составила 43,4 кДа.
Взаимодействие антител А9 и тА9 с рекомбинантным TNF человека. Кинетика взаимодействия антител А9 и тА9 с рекомбинантным TNF человека измерялась методом поверхностного-плазмонного резонанса. Для этого оба антитела в концентрации 50 нМ были иммобилизованы на поверхности сенсорного чипа, после чего рекомбинантный TNF человека в серийных разведениях 50-3 нМ был нанесен в качестве аналита, а кинетика взаимодействия измерялась на приборе ProteOn XPR36. Оба антитела показали высокую аффинность: Kd А9 и тА9 составила 85 и 95 пМ соответственно. Это подтверждает, что внесенные мутации не повлияли на связывание с TNF. Кроме того оба антитела обладали сходными параметрами скорости связывания (Kforward, on-rate) и скорости диссоциации (Kreverse, off-rate) - приведены на Рис. 33 и в Таб. 3. Малая скорость диссоциации должна позволить антителу А9 удерживать связанный TNF.
Получение и характеристика нового рекомбинантного одно доменного антитела, специфически связывающегося с TNF человека, но не блокирующего его биологическую активность
Кинетика взаимодействия антител А9 и тА9 с рекомбинантным TNF человека измерялась методом поверхностного-плазмонного резонанса. Для этого оба антитела в концентрации 50 нМ были иммобилизованы на поверхности сенсорного чипа, после чего рекомбинантный TNF человека в серийных разведениях 50-3 нМ был нанесен в качестве аналита, а кинетика взаимодействия измерялась на приборе ProteOn XPR36. Оба антитела показали высокую аффинность: Kd А9 и тА9 составила 85 и 95 пМ соответственно. Это подтверждает, что внесенные мутации не повлияли на связывание с TNF. Кроме того оба антитела обладали сходными параметрами скорости связывания (Kforward, on-rate) и скорости диссоциации (Kreverse, off-rate) - приведены на Рис. 33 и в Таб. 3. Малая скорость диссоциации должна позволить антителу А9 удерживать связанный TNF.
Кинетика взаимодействия биспецифического антитела А9 и контрольного антитела тА9 с рекомбинантным TNF человека. (А) Приведены кривые взаимодействия (сенсограммы) рекомбинантного TNF человека в концентрациях 50 нМ - 3 нМ с сенсорным чипом, на котором были иммобилизованы биспецифическое антитело А9 и контрольное антитело тА9. По оси абсцисс отложено время в секундах, по оси ординат сдвиг угла резонанса в условных единицах (УЕ). (Б) Для каждой группы сенсограмм были расчитаны значения скорости связывания (оп-rate), скорости диссоциации (off-rate) и константы диссоциации (Kd). Полученные средние значения, а также стандартное отклонение (SD) отложены на диаграмме изоаффиности. Диагональные линии соответсвуют указанным значениям константы диссоциации.
Для оценки сравнительной активности антитела А9 в ингибировании биологических эффектов TNF проводился цитотоксический текст на линии мышиной фибросаркомы L929. К постоянным концентрациям рекомбинантного TNF человека и актиномицина-D добавлялись серийные разведения антител А9 и тА9. Согласно полученным данным антитела А9 и тА9 имеют близкую антиNF активность (Рис. 34 А). Кроме того было подтверждено, что активность биспецифического антитела А9 соответствует активности однодоменного антиNF антитела hTNF-VffH, которое входит в состав А9 и тА9 (Рис. 34 Б). 10 10 10
АнтиNF активность биспецифического антитела А9, контрольного антитела mA9 и однодоменного антитела hTNF-VffH. (А) Сравнение активности биспецифического антитела А9 и контрольного антитела тА9. Приведена кривая выживаемости клеток мышиной фибросаркомы L929 при одновременном воздействии константной дозы TNF человека и убывающих доз антител А9 и тА9. (Б) Сравнение активности биспецифического антитела А9 и однодоменного антитела hTNF-VnH. Приведена кривая выживаемости клеток мышиной фибросаркомы L929 при одновременном воздействии константной дозы TNF человека и убывающих доз антител А9 и hTNF-VHH.Сравнение проводилось в молярных концентрациях для того, чтобы исключить влияния различий в молярной массе на определяемую активность антитела.
Анализ связывания антител А9 и тА9 с поверхностью макрофагов через взаимодействие с поверхностной молекулой F4/80.
Способность биспецифического антитела А9 специфически связываться с поверхностью макрофагов была оценена методом проточной цитофлуориметрии. Для этого клетки, выделенные из перитонеальной полости, инкубировались с антителами А9, после чего проводилось окращивание на макрофагальные маркеры CD1 lb и F4/80, одновременно осуществлялось специфическое окрашивание на биспецифическое антитело А9 через антитела к VHH ИЛИ антитела к полигистидиновой метке. Затем образцы подвергались проточной цитофлуориметрии и анализу.
Эти эксперименты показали, что биспецифическое антитело А9 способно связываться с поверхностью перитонеальных клеток, экспрессирующих F4/80 и CD1 lb на своей поверхности (моноциты и макрофаги) (Рис. 35 А - Г). В то же время, А9 не связывается с клетками перитонеальной полости, не имеющими этих маркеров (преимущественно лимфоциты) (Рис. 35 Д и Е). Снижения уровня параллельного анти-F4/80 окрашивания при добавлении антитела А9 за счет конкуренции двух антител за связывание с мишенью подтверждает, что А9 специфически взаимодействует именно с этой молекулой на поверхности клеток (Рис. 35 Ж и 3).
Также используется название Мас-1. Составной элемент рецептора СЗ компонента системы комплемента. У мышей экспрессируется на моноцитах, макрофагах и клетках микроглии. биспецифическое антитело
Клетки перитонеальной полости инкубировались с биспецифическим антителом А9 (изображено красным цветом) или без него (изображено синим цветом), а затем подвергались окрашиванию флуоресцентно меченными антителами к поверхностным маркерам, специфичным для клеток моноцитарно-макрофагального ряда, а также антителами, специфичными к А9. Затем полученные образцы анализировались методом проточной цитофлуориметрии. (А, В, Д, Ж) окрашивание через антитела к VHH домену. (Б, Г, Е, 3) окрашивание через антитела к полигексидиновой последовательности. (А, Б) биспецифическое антитело А9 связывается с клетками, отобранными по высокому уровню экспрессии F4/80 и CD1 lb (макрофаги). На изображеной гистограмме по горизонтальной оси отложено значение флуоресценции в канале окрашивания на А9, по вертикальной оси нормализованная частота встречаемости события. (В, Г) то же самое в форме гистограммы рассеяния. По горизонтальной оси отложено значение флуоресценции в канале окрашивания на А9, по вертикальной оси значение флуоресценции в канале окрашивания на F4/80. (Д, Е) -биспецифическое антитело А9 не связывается с клетками перитонеальной полости, не экспрессирующими F4/80 и CD1 lb (лимфоциты). На изображеной гистограмме по горизонтальной оси отложено значение флуоресценции в канале окрашивания на А9, по вертикальной оси нормализованная частота встречаемости события. (Ж, 3) -инкубация с биспецифическим антителом А9 снижает интенсивность окрашивания на F4/80. На изображеной гистограмме по горизонтальной оси отложено значение флуоресценции в канале окрашивания на F4/80, по вертикальной оси нормализованная частота встречаемости события.
Костномозговые макрофаги инкубировались с биспецифическим антителом А9 (изображено красным цветом), без него (изображено синим цветом), или с контрольным антителом тА9 (изображено черным цветом) а затем подвергались окрашиванию антителами, специфичными к А9/тА9. Полученные образцы анализировались методом проточной цитофлуориметрии. (А) биспецифическое антитело А9 специфически связывается с костномозговыми макрофагами. На изображеной гистограмме по горизонтальной оси отложено значение флуоресценции в канале окрашивания на А9, по вертикальной оси нормализованная частота встречаемости события. (Б) контрольное антитело шА9 неспособно связываться с костномозговыми макрофагами. На изображеной гистограмме по горизонтальной оси отложено значение флуоресценции в канале окрашивания на шА9, по вертикальной оси нормализованная частота встречаемости события.
Кроме того, в дополнительных цитофлуориметрических экспериментах было показано, что антитело А9, будучи прикрепленным к поверхности макрофагов, способно одновременно связывать экзогенно добавленный TNF человека (Рис. 37). Что подтверждает, что обе субъединицы биспецифического антитела функционально активны одновременно, и что связывание двух антигенов одновременно стерически возможно.
Клетки перитонеальной полости инкубировались с биспецифическим антителом А9 (изображено красным цветом) или без него (изображено синим цветом), затем с рекомбинантным TNF человека, после чего подвергались окрашиванию флуоресцентно-меченными антителами к поверхностным маркерам, специфичным для клеток моноцитарно-макрофагального ряда, а также антителами, специфичными к TNF человека. Полученные образцы анализировались методом проточной цитофлуориметрии. (А) биспецифическое антитело А9, способно удерживать TNF человека на поверхности макрофагов (клеток, отобранных по высокому уровню экспрессии F4/80 и CD1 lb). На изображеной гистограмме по горизонтальной оси отложено значение флуоресценции в канале окрашивания на TNF, по вертикальной оси нормализованная частота встречаемости события. (Б) те же данные в форме гистограммы рассеяния. По горизонтальной оси отложены значения флуоресценции в канале окрашивания на TNF, по вертикальной оси значения флуоресценции в канале окрашивания на F4/80.
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Курсовая работа
по дисциплине: Сельскохозяйственная биотехнология
на тему: «Белковая инженерия»
- Реферат
- Введение
- I. Белковая инженерия
- 1.1 Понятие белковой инженерии. История развития
- II. Примеры инженерных белков
- 3.3 Некоторые достижения белковой инженерии.
- Заключение
- Список литературы
Тема работы: Белковая инженерия.
Ключевые слова: биотехнология, генная инженерия, белок, генетический код, ген, ДНК, РНК, АТФ, пептиды, эпитоп.
Цель курсовой работы: изучение понятия «белковая инженерия» и потенциальных возможностей её использования.
Потенциальные возможности белковой инженерии:
1. Изменив прочность связывания преобразуемого вещества - субстрата - с ферментом, можно повысить общую каталитическую эффективность ферментативной реакции.
2. Повысив стабильность белка в широком диапазоне температур и кислотности среды, можно использовать его в условиях, при которых исходный белок денатурирует и теряет свою активность.
3. Создав белки, способные функционировать в безводных растворителях, можно осуществлять каталитические реакции в нефизиологических условиях.
4. Изменив каталитический центр фермента, можно повысить его специфичность и уменьшить число нежелательных побочных реакций
5. Повысив устойчивость белка к расщепляющим его ферментам, можно упростить процедуру его очистки.
6. Изменив белок таким образом, чтобы он мог функционировать без обычного для него не аминокислотного компонента (витамина, атома металла и т.п.), можно использовать его в некоторых непрерывных технологических процессах.
7. Изменив структуру регуляторных участков фермента, можно уменьшить степень его торможения продуктом ферментативной реакции по типу отрицательной обратной связи и тем самым увеличить выход продукта.
8. Можно создать гибридный белок, обладающий функциями двух и более белков.
9. Можно создать гибридный белок, один из участков которого облегчает выход гибридного белка из культивируемой клетки или извлечение его из смеси.
Введение
С незапамятных времен биотехнология применялась преимущественно в пищевой и легкой промышленности: в виноделии, хлебопечении, сбраживании молочных продуктов, при обработке льна и кож, основанных на применении микроорганизмов. В последние десятилетия возможности биотехнологии необычайно расширились. Это связано с тем, что ее методы выгоднее обычных по той простой причине, что в живых организмах биохимические реакции, катализируемые ферментами, идут при оптимальных условиях (температуре и давлении), более производительны, экологически чисты и не требуют химических реактивов, отравляющих среду .
Объектами биотехнологии являются многочисленные представители групп живых организмов -- микроорганизмы (вирусы, бактерии, простейшие, дрожжевые грибы), растения, животные, а также изолированные из них клетки и субклеточные компоненты (органеллы) и даже ферменты. Биотехнология базируется на протекающих в живых системах физиолого-биохимических процессах, в результате которых осуществляются выделение энергии, синтез и расщепление продуктов метаболизма, формирование химических и структурных компонентов клетки.
Главным направлением биотехнологии является производство с помощью микроорганизмов и культивируемых эукариотических клеток биологически активных соединений (ферменты, витамины, гормоны), лекарственных препаратов (антибиотики, вакцины, сыворотки, высокоспецифичные антитела и др.), а также ценных соединений (кормовые добавки, например, незаменимые аминокислоты, кормовые белки и т. д.).
Методы генетической инженерии позволили осуществить синтез в промышленных количествах таких гормонов, как инсулин и соматотропин (гормон роста), которые необходимы для лечения генетических болезней человека.
Биотехнология решает не только конкретные задачи науки и производства. У нее есть более глобальная методологическая задача -- она расширяет и ускоряет масштабы воздействия человека на живую природу и способствует адаптации живых систем к условиям существования человека, т. е. к ноосфере. Биотехнология, таким образом, выступает в роли мощного фактора антропогенной адаптивной эволюции.
У биотехнологии, генетической и клеточной инженерии многообещающие перспективы. При появлении все новых и новых векторов человек с их помощью будет внедрять нужные гены в клетки растений, животных и человека. Это позволит постепенно избавиться от многих наследственных болезней человека, заставить клетки синтезировать необходимые лекарства и биологически активные соединения, а затем -- непосредственно белки и незаменимые аминокислоты, употребляемые в пищу. Используя методы, уже освоенные природой, биотехнологи надеются получать с помощью фотосинтеза водород -- самое экологически чистое топливо будущего, электроэнергию, превращать в аммиак атмосферный азот при обычных условиях .
Физические и химические свойства природных белков часто не удовлетворяют условиям, в которых эти белки будут использоваться человеком. Требуется изменение его первичной структуры, которое обеспечит формирование белка с иной, чем прежде, пространственной структурой и новыми физико-химическими свойствами, позволяющими и в иных условиях выполнять присущие природному белку функции. Конструированием белков занимается белковая инженерия .
Еще одной областью применения белковой инженерии является создание белков, способных нейтрализовать вещества и микроорганизмы, которые могут быть использованы для химических и биологических атак. Например, ферменты гидролазы способны обезвреживать как нервнопаралитические газы, так и используемые в сельском хозяйстве пестициды. При этом производство, хранение и использование ферментов не опасно для окружающей среды и здоровья людей.
Для получения измененного белка используют методы комбинаторной химии и осуществляют направленный мутагенез - внесение специфических изменений в кодирующие последовательности ДНК, приводящие к определенным изменениям в аминокислотных последовательностях. Для эффективного конструирования белка с заданными свойствами необходимо знать закономерности формирования пространственной структуры белка, от которой зависят его физико-химические свойства и функции, то есть необходимо знать, как первичная структура белка, каждый его аминокислотный остаток влияет на свойства и функции белка. К сожалению, для большинства белков неизвестна третичная структура, не всегда бывает известно, какую именно аминокислоту или последовательность аминокислот нужно изменить, чтобы получить белок с нужными свойствами. Уже сейчас ученые с помощью компьютерного анализа могут предсказывать свойства многих белков, исходя из последовательности их аминокислотных остатков. Подобный анализ значительно упростит процедуру создания нужных белков. Пока же для того, чтобы получить измененный белок с нужными свойствами, идут в основном иным путем: получают несколько мутантных генов и находят тот белковый продукт одного из них, который обладает нужными свойствами.
Для направленного мутагенеза используют разные экспериментальные подходы. Получив измененный ген, его встраивают в генетическую конструкцию и вводят ее в прокариотические или эукариотические клетки, осуществляющие синтез белка, кодируемого этой генетической конструкцией .
I. Белковая инженерия
1.1 Понятие белковой инженерии. История развития
Белковая инженерия (англ. Protein engineering) -- раздел биотехнологии, который занимается разработкой полезных или ценных белков. Это относительно новая дисциплина, которая направлена на исследование фолдинга белков и принципов модификации и создания белков.
Существуют две основные стратегии для белковой инженерии: направленная модификация белка и направленная эволюция. Эти методы не являются взаимоисключающими; исследователи часто применяют оба. В будущем, более детальное знание структуры и функции белков, а также достижения в области высоких технологий, может значительно расширить возможности белковой инженерии. В итоге, даже неприродные аминокислоты могут быть включены благодаря новому методу, который позволяет включать новые аминокислоты в генетический код .
Белковая инженерия зародилась на стыке физики и химии белка и генетической инженерии. Она решает задачу создания модифицированных или гибридных молекул белков с заданными характеристиками. Естественным путем реализации такой задачи является предсказание структуры гена, кодирующего измененный белок, осуществление его синтеза, клонирования и экспрессии в реципиентных клетках .
Первая контролируемая модификация белка была проведена в середине 60-х годов Кошландом и Бендером. Для замены гидроксильной группы на сульфгидрильную в активном центре протеазы -- субтилизина они применили метод химической модификации. Однако, как выяснилось, такой тиолсубтилизин не сохраняет протеазную активность.
Белок в химическом отношении представляет собой однотипную молекулу, которая является полиаминокислотной цепочкой или полимером. Составлен он из аминокислотных последовательностей 20 типов. Узнав строение белков, люди задались вопросом: можно ли спроектировать абсолютно новые аминокислотные последовательности, чтобы они выполняли нужные человеку функции гораздо лучше, чем обычные белки? Для данной идеи подошло название Белковая инженерия .
О такой инженерии стали задумываться ещё в 50-е годы XX столетия. Случилось это сразу же после расшифровки первых белковых аминокислотных последовательностей. Во многих лабораториях мира начали делать попытки дублировать природу и синтезировать химическим путём заданные абсолютно произвольно полиаминокислотные последовательности.
Больше всех в этом преуспел химик Б. Меррифилд. Этому американцу удалось разработать чрезвычайно эффективный метод синтеза полиаминокислотных цепей. За это Меррифилду в 1984 году присудили Нобелевскую премию по химии.
Рисунок 1. Схема функционирования белковой инженерии
Американец начал синтезировать короткие пептиды, включая гормоны. При этом построил автомат - «химического робота» - в задачу которого входило производит искусственные белки. Робот вызвал сенсацию в научных кругах. Однако скоро выяснилось, что его продукция не может конкурировать с тем, что производит природа.
Робот не мог в точности воспроизводить аминокислотные последовательности, то есть ошибался. Он синтезировал одну цепь с одной последовательностью, а другую уже с немного изменённой. В клетке же все молекулы одного белка идеально похожи друг на друга, то есть их последовательности абсолютно одинаковые.
Была и другая проблема. Даже те молекулы, которые робот синтезировал правильно, не принимали ту пространственную форму, которая необходима для функционирования фермента. Таким образом, попытка подменить природу обычными методами органической химии привела к весьма скромному успеху.
Учёным оставалось учиться у природы, выискивая нужные модификации белков. Тут дело в том, что в природе постоянно идут мутации, ведущие к изменению аминокислотных последовательностей белков. Если отобрать мутантов с необходимыми свойствами, более эффективно перерабатывающих тот или иной субстрат, то можно выделить из такого мутанта измененный фермент, благодаря которому клетка приобретает новые свойства. Но данный процесс занимает очень большой период времени.
Все изменилось тогда, когда появилась генная инженерия. Благодаря ей, стали создавать искусственные гены с любой последовательностью нуклеотидов. Эти гены встраивали в приготовленные молекулы-векторы и внедряли эти ДНК в бактерии или дрожжи. Там с искусственного гена снималась копия РНК. В результате этого вырабатывался нужный белок. Ошибки в его синтезе исключались. Главное, надо было подобрать нужную последовательность ДНК, а дальше уже ферментная система клетки сама безупречно делала своё дело. Таким образом, можно заключить, что генная инженерия открыла путь белковой инженерии в самой радикальной форме .
1.2 Стратегии белковой инженерии
Направленная модификация белка. При направленной модификации белка ученый использует детальное знание структуры и функции белка, чтобы внести нужные изменения. Как правило, этот метод имеет то преимущество, что он недорогой и технически несложный, так как техника сайт-направленного мутагенеза хорошо развита. Однако, его основным недостатком является то, что сведения о подробной структуре белка часто отсутствуют, и даже когда структура известна, может быть очень трудно предсказать влияние различных мутаций.
Программные алгоритмы модификации белка стремятся к выявлению новых аминокислотных последовательностей, которые требуют мало энергии для формирования предопределенной целевой структуры. В то время как последовательность, которая должно быть найдена, велика, наиболее сложным требованием для модификации белка является быстрый, но точный, способ для выявления и определения оптимальной последовательности, в отличие ее от аналогичных субоптимальных последовательностей .
Направленная эволюция. В направленной эволюции случайный мутагенез применяется к белку и селекция идет так, чтобы выбрать варианты, которые имеют определенные качества. Далее применяются еще раунды мутации и селекции. Этот метод имитирует естественную эволюцию и в целом позволяет получить превосходные результаты для направленной модификации.
Дополнительный метод, известный как ДНК-перетасовки, смешивает и выявляет части удачных вариантов для получения лучших результатов. Этот процесс имитирует рекомбинации, которые происходят естественно во время полового размножения. Преимуществом направленной эволюции является то, что она не требует предварительных знаний о структуре белка, да и не нужно, чтобы иметь возможность прогнозировать, какое влияние данная мутация будет иметь. В самом деле, результаты экспериментов направленной эволюции удивляют, поскольку желаемые изменения часто бывают вызваны мутациями, которые не должны были иметь такой эффект. Недостатком является то, что этот метод требует высокой пропускной способности, который не представляется возможным для всех белков. Большое количество рекомбинантной ДНК должно быть мутированным и необходимо провести скрининг продуктов на выявление желаемого качества. Огромное количество вариантов часто требует покупки робототехники для автоматизации процесса. Кроме того, не всегда легко провести скрининг на выявление всех интересующих качеств .
II. Примеры инженерных белков
Белковая инженерия может быть основана на химической модификации готового белка или на методах генетической инженерии, позволяющих получать модифицированные варианты природных белков .
Конструирование определенного биологического катализатора ведется с учетом как специфичности белка, так и каталитической активности металлоорганического комплекса. Вот примеры такой модификации, проведенной для получения «полусинтетических биоорганических комплексов». Миоглобин кашалота способен связывать кислород, но не обладает биокаталитической активностью. В результате объединения этой биомолекулы с тремя электрон-переносящими комплексами, содержащими рутений, которые связываются с остатками гистидина на поверхности молекул белка, образуется комплекс, способный восстанавливать кислород при одновременном окислении ряда органических субстратов, например аскорбата, со скоростью почти такой же, как для природной аскорбатоксидазы. В принципе белки можно модифицировать и другими способами. Рассмотрим, например, папаин. Он относится к числу хорошо изученных протеолитических ферментов, для которого определена трехмерная структура. Поблизости от остатка цистеина-25 на поверхности белковой молекулы располагается протяженный желобок, в котором протекает реакция протеолиза. Этот участок может быть алкилирован производным флавина без изменения доступности участка связывания потенциальных субстратов. Такие модифицированные флавопапаины использовались для окисления М-алкил-1,4-дигидроникотинамидов, и каталитическая активность некоторых из этих модифицированных белков была существенно выше, чем у природных флавопротеин-NADH-дегидрогеназ. Таким образом удалось создать очень эффективный полусинтетический фермент. Использование флавинов с высокоактивными, находящимися в определенном положении электрон-оттягивающими заместителями, возможно, позволит разработать эффективные катализаторы для восстановления никотин-амида.
Крупные успехи, достигнутые за последнее время в химическом синтезе ДНК, открыли перед белковой инженерией принципиально новые возможности: конструирование уникальных, не встречающихся в природе белков. Для этого необходимо и дальнейшее развитие технологии, так чтобы изменение генов методами генетической инженерии приводило к предсказуемым изменениям белков, к улучшению вполне определенных функциональных их характеристик: числа оборотов, Км для конкретного субстрата, термостабильности, температурного оптимума, стабильности и активности в неводных растворителях, субстратной и реакционной специфичности, потребности в кофакторах, оптимуме рН, устойчивости к протеазам, аллостерической регуляции, молекулярной массы и субъединичного строения. Обычно такого улучшения достигали с помощью мутагенеза и отбора, а в последнее время -- путем химической модификации и иммобилизации. Для успешного конструирования конкретного типа молекул белка необходимо выявить ряд основополагающих закономерностей, связывающих структурные особенности белков и их желаемые свойства. Так, зная точную кристаллическую структуру молекулы изучаемого белка, можно идентифицировать те ее участки, которые следует направленно модифицировать для увеличения его каталитической активности. Такая модификация может состоять в изменении аминокислотной последовательности белка .
Ещё одним примером может служить осуществление сайт-специфического мутагенеза. Он происходит следующим образом. Клонируют ген того белка, который интересует исследователя, и встраивают его в подходящий генетический носитель. Затем синтезируют олигонуклеотидную затравку с желаемой мутацией, последовательность которой из десяти -- пятнадцати нуклеотидов в достаточной степени гомологична определенному участку природного гена и поэтому способна образовывать с ним гибридную структуру. Эта синтетическая затравка используется полимеразами для начала синтеза комплементарной копии вектора, которую затем отделяют от оригинала и используют для контролируемого синтеза мутантного белка. Альтернативный подход основан на расщеплении цепи, удалении подлежащего изменению сайта и замещении его синтетическим аналогом с желаемой последовательностью нуклеотидов.
Тирозил-тРНК--синтетаза катализирует реакцию аминоацилирования тирозиновой тРНК, которая включает активирование тирозина с помощью АТР с образованием тирозиладенилата. Ген этого фермента, выделенный из Bacillus stearothermophilus, был встроен в бактериофаг М13. Затем каталитические свойства фермента, особенно его способность связывать субстрат, были изменены путем сайт-специфической модификации. Так, треонин-51 был заменен на аланин. Это привело к двукратному увеличению связывания субстрата, видимо, из-за невозможности образования водородной связи между этим остатком и тирозил-аденилатом. При замене аланина пролином нарушается конфигурация молекулы фермента, но способность к связыванию субстрата увеличивается в сто раз, так как облегчается его взаимодействие с гистидином-48. Сходные сайт-специфичные изменения, были получены в р-лактамазе, и обычно они сопровождались инактивацией фермента. Замена серина-70 на цистеин приводит к образованию р-тиоллактамазы, константа связывания у которой не отличается от таковой для природного фермента, но активность по отношению к пенициллину составляет всего 1-2%. Тем не менее активность этого мутантного фермента в отношении некоторых активированных цефалоспоринов не меньше исходной активности или даже превышает ее; эти белки также более устойчивы к действию протеаз.
Мутации, вызываемые путем сайт-специфичного воздействия, используют сегодня для проверки адекватности результатов структурных исследований. В некоторых случаях с их помощью удалось показать, что структурная стабильность белка и его каталитическая активность могут быть разобщены. Накопилось достаточное количество информации о взаимосвязи между стабильностью структуры белка и его функцией, мы, возможно, сумеем осуществлять тонкую регуляцию активности биологических катализаторов и создавать полностью синтетические их аналоги. Недавно появилась работа, в которой сообщалось о клонировании первого синтетического гена фермента, кодирующего активный фрагмент молекулы рибонуклеазы .
III. Применение белковой инженерии
Технология белковой инженерии используется (часто - в сочетании с методом рекомбинантных ДНК) для улучшения свойств существующих белков (ферментов, антител, клеточных рецепторов) и создания новых, не существующих в природе протеинов. Такие белки применяются для создания лекарственных препаратов, при обработке пищевых продуктов и в промышленном производстве .
В настоящее время наиболее популярной областью применения белковой инженерии является изменение каталитических свойств ферментов для разработки «экологически дружественных» промышленных процессов. С точки зрения охраны окружающей среды ферменты являются наиболее приемлемыми из всех катализаторов, используемых в промышленности. Это обеспечивается способностью биокатализаторов растворяться в воде и полноценно функционировать в среде с нейтральным рН и при сравнительно низких температурах. Кроме того, благодаря их высокой специфичности, в результате применения биокатализаторов образуется совсем немного нежелательных побочных продуктов производства. Экологически чистые и энергосберегающие промышленные процессы, использующие биокатализаторы, уже давно активно внедряются химической, текстильной, фармацевтической, целлюлозно-бумажной, пищевой, энергетической и других областях современной промышленности.
Однако некоторые характеристики биокатализаторов делают их использование в ряде случаев неприемлемым. Например, большинство ферментов распадается при повышении температуры. Ученые пытаются преодолеть подобные препятствия и увеличить стабильность ферментов в суровых условиях производства с помощью методов белковой инженерии .
Кроме промышленного применения, белковая инженерия нашла себе достойное место и в медицинских разработках. Исследователи синтезируют белки, способные связываться с вирусами и мутантными генами, вызывающими опухоли, и обезвреживать их; создают высокоэффективные вакцины и изучают белки-рецепторы клеточной поверхности, которые часто являются мишенями для фармацевтических препаратов. Ученые, занимающиеся усовершенствованием продуктов питания, используют белковую инженерию для улучшения качеств белков, обеспечивающих сохранность продуктов растительного происхождения, а также желирующих веществ или загустителей.
3.1 Библиотеки пептидов и эпитопов
В живом организме большинство биологических процессов управляется посредством специфических белок-белковых или белково-нуклеиновых взаимодействий. К таким процессам относятся, например регуляция транскрипции генов под действием различных белковых факторов, взаимодействие белковых лигандов с рецепторами на поверхности клеток, а также специфическое связывание антигенов соответствующими антителами. Понимание молекулярных механизмов взаимодействия белковых лигандов с рецепторами имеет большое фундаментальное и прикладное значение. В частности, разработка новых лекарственных препаратов белковой природы обычно начинается с идентификации исходной последовательности аминокислот, обладающей требуемой биологической активностью (так называемая "основная" (lead) последовательность). Однако пептиды с основной последовательностью аминокислот могут обладать и нежелательными биологическими свойствами: низкой активностью, токсичностью, малой стабильностью в организме и т.п.
До появления библиотек пептидов улучшение их биологических свойств осуществляли путем последовательного синтеза большого числа аналогов и проверкой их биологической активности, что требовало больших затрат времени и средств. В последние годы появилась возможность с помощью автоматических синтезаторов создавать за короткое время тысячи различных пептидов. Разработанные методы направленного мутагенеза также позволили резко расширить число белков, получаемых одновременно и последовательно тестируемых на биологическую активность. Однако только недавно разработанные подходы к созданию библиотек пептидов привели к получению миллионов последовательностей аминокислот, требуемых для проведения эффективного скрининга с целью выявления среди них пептидов, максимально удовлетворяющих предъявляемым критериям. Такие библиотеки используются для исследования взаимодействия антител с антигенами, получения новых ингибиторов ферментов и антимикробных агентов, конструирования молекул, обладающих требуемой биологической активностью, или придания новых свойств белкам, например антителам .
По способам получения библиотеки пептидов разделяются на три группы. К первой группе можно отнести библиотеки, полученные с использованием химического синтеза пептидов, в которых индивидуальные пептиды иммобилизованы на микроносителях. При таком подходе после присоединения очередных аминокислот в индивидуальных реакционных смесях к пептидам, иммобилизованным на микроносителях, содержимое всех реакционных смесей объединяют и разделяют на новые порции, которые используют на следующей стадии присоединения новых аминокислотных остатков. После проведения ряда таких этапов оказываются синтезированными пептиды, содержащие последовательности использованных в синтезе аминокислот во всевозможных случайных сочетаниях.
Библиотеки пептидов, иммобилизованных на микроносителях, обладают существенным недостатком: они требуют при скрининге использования очищенных рецепторов, находящихся в растворимой форме. В то же время в большинстве случаев при биологических испытаниях, проводящихся для фундаментальных и фармакологических исследований, чаще всего находят применение рецепторы, ассоциированные с мембранами. По второму способу библиотеки пептидов получают с помощью твердофазного синтеза пептидов, при котором на каждой стадии химического присоединения очередной аминокислоты к растущим пептидным цепям используют эквимолярные смеси всех или некоторых аминокислот-предшественников. На конечной стадии синтеза проводят отделение пептидов от носителя, т.е. перевод их в растворимую форму. Третий подход к конструированию библиотек пептидов, к описанию которого мы сейчас переходим, стал реальным именно благодаря развитию методов генной инженерии. Он прекрасно иллюстрирует возможности таких методов и, несомненно, является крупным достижением в их применении. В этой связи рассмотрим более подробно результаты использования библиотек пептидов в исследовании эпитопов (антигенных детерминант) белков .
Генно-инженерная технология получения гибридных белков позволила разработать эффективный метод наработки коротких пептидов для анализа их биологической активности. Как и в случае клонотек генов, библиотеки пептидов, полученные генно-инженерными методами, представляют собой большой (часто исчерпывающий) набор коротких пептидов. Два недавно сделанных наблюдения позволяют рассматривать библиотеку пептидов одновременно и в качестве библиотеки эпитопов белков. Во-первых, короткие пептиды могут включать все основные остатки аминокислот, играющие главную роль во взаимодействии с антителами, и они в состоянии имитировать крупные антигенные детерминанты белков. Во-вторых, в большинстве случаев нековалентные связи, образуемые между немногими наиболее важными остатками аминокислот белковых лигандов и их рецепторами, вносят основной вклад в общую энергию взаимодействия лиганд-рецептор. С учетом этого любой пептид можно рассматривать как потенциальный лиганд, гаптен или часть антигенной детерминанты более крупных полипептидов, а любую библиотеку пептидов - как библиотеку эпитопов белков или потенциальных лигандов для соответствующих белковых рецепторов.
Библиотека пептидов, полученная в результате реализации третьего подхода, в современном виде представляет собой набор десятков или даже сотен миллионов коротких различающихся последовательностей аминокислот, которые экспрессированы на поверхности вирионов бактериофагов в составе их собственных структурных белков. Это становится возможным благодаря введению методами генной инженерии в геном бактериофагов гибридных рекомбинантных генов, кодирующих измененные структурные белки его вирионов. (Данный метод известен под названием фагового дисплея.) В результате экспрессии таких генов образуются гибридные белки, на N- или С-концах которых присутствуют дополнительные последовательности аминокислот.
Библиотеки пептидов и эпитопов найдут свое применение и в исследованиях механизмов гуморального иммунного ответа, а также заболеваний иммунной системы. В частности, большинство аутоиммунных заболеваний сопровождается образованием аутоантител против антигенов собственного организма. Эти антитела во многих случаях служат специфическими маркерами того или иного аутоиммунного заболевания. С использованием библиотеки эпитопов, в принципе, можно получить пептидные маркеры, с помощью которых было бы возможно следить за специфичностью аутоантител во время развития патологического процесса как в индивидуальном организме, так и в группе пациентов и, кроме того, определять специфичность аутоантител при заболеваниях неизвестной этиологии.
Библиотеки пептидов и эпитопов потенциально могут быть использованы также для скрининга иммунных сывороток с целью выявления пептидов, специфически взаимодействующих с защитными антителами. Такие пептиды будут имитировать антигенные детерминанты патогенных организмов и служить мишенями для защитных антител организма. Это позволит использовать подобные пептиды для вакцинации пациентов, у которых отсутствуют антитела против соответствующих патогенов. Изучение эпитопов с помощью библиотек пептидов является частным случаем одного из многочисленных направлений их использования в прикладных и фундаментальных исследованиях взаимодействия лигандов и рецепторов. Дальнейшее усовершенствование этого подхода должно способствовать созданию новых лекарственных препаратов на основе коротких пептидов и быть полезным в фундаментальных исследованиях механизмов белок-белковых взаимодействий .
3.2 Белки-репортеры в гибридных белках
В другом случае гибридные белки применяют для получения высокого уровня экспрессии коротких пептидов в бактериальных клетках благодаря стабилизации этих пептидов в составе гибридных белков. Часто гибридные белки используют для идентификации и очистки трудноопределяемых рекомбинантных белков. Например, присоединив к С-концу исследуемого белка в качестве белка-репортера галактозидазу, можно производить очистку рекомбинантного белка по активности галактозидазы, определяя ее антигенные детерминанты иммунохимическими методами. Соединяя фрагменты ДНК, содержащие открытые рамки считывания (ОРС), с генами белков-репортеров, можно очистить такие гибридные белки по активности белка-репортера и использовать их для иммунизации лабораторных животных. Полученные антитела далее применяют для очистки нативного белка, в состав которого входит рекомбинантный полипептид, кодируемый ОРС, и тем самым идентифицируют клонированный фрагмент гена .
С помощью гибридных белков решают и обратную задачу клонирования неизвестного гена, к белковому продукту которого имеются антитела. В таком случае конструируют клонотеку последовательностей нуклеотидов, представляющих ОРС неизвестных генов, в векторах, которые позволяют соединять клонируемую ОРС в одной рамке считывания с геном-репортером. Образующиеся в результате экспрессии этих рекомбинантных генов гибридные белки идентифицируются с помощью антител иммуноферментными методами. Гибридные гены, объединяющие секретируемые белки и белки-репортеры, дают возможность по-новому исследовать механизмы секреции, а также локализацию и перемещение в тканях секретируемых белков .
3.3 Некоторые достижения белковой инженерии
1. Заменив несколько аминокислотных остатков лизоцима бактериофага Т4 на цистеин получен фермент с большим числом дисульфидных связей, благодаря чему этот фермент сохранил свою активность при более высокой температуре.
2. Замена остатка цистеина на остаток серина в молекуле р-интерферона человека, синтезируемого кишечной палочкой, предотвращала образование межмолекулярных комплексов, при котором примерно в 10 раз уменьшалась противовирусная активность этого лекарственного средства.
3. Замена остатка треонина на остаток пролина в молекуле фермента тирозил-тРНК-синтетазы повысило каталитическую активность этого фермента в десятки раз: он стал быстрее присоединять тирозин к тРНК, переносящей эту аминокислоту в рибосому в ходе трансляции.
4. Субтилизины - богатые серином ферменты, расщепляющие белки. Они секретируются многими бактериями и широко используются человеком для биодеградации. Они прочно связывают атомы кальция, повышающие их стабильность. Однако в промышленных процессах присутствуют химические соединения, которые связывают кальций, после чего субтилизины теряют свою активность. Изменив ген, ученые удалили из фермента аминокислоты, участвующие в связывании кальция, и заменили одну аминокислоту на другую с целью повышения стабильности субтилизина. Измененный фермент оказался стабильным и функционально активным в условиях, близких к промышленным.
5. Была показана возможность создания фермента, функционирующего по типу рестриктаз, расщепляющих ДНК в строго определенных местах. Ученые создали гибридный белок, один фрагмент которого узнавал определенную последовательность нуклеотидных остатков в молекуле ДНК, а другой расщеплял ДНК в этом участке.
6. Активатор тканевого плазминогена - фермент, который используют в клинике для растворения сгустков крови. К сожалению, он быстро выводится из системы кровообращения и его приходится вводить повторно или в больших дозах, что приводит к побочным эффектам. Внеся три направленные мутации в ген этого фермента, получили долгоживущий фермент, обладающий повышенным сродством к разрушаемому фибрину и с такой же фибринолитической активностью, как у исходного фермента.
7. Произведя замену одной аминокислоты в молекуле инсулина, ученые добились того, что при подкожном введении этого гормона больным, страдающим диабетом, изменение концентрации этого гормона в крови было близко к физиологическому, возникающему после приема пищи.
8. Существует три класса интерферонов, обладающих противовирусной и противораковой активностью, но проявляющих разную специфичность. Заманчиво было создать гибридный интерферон, обладающий свойствами интерферонов трех типов. Были созданы гибридные гены, включающие в себя фрагменты природных генов интерферонов нескольких типов. Часть этих генов, будучи встроенными в бактериальные клетки, обеспечивали синтез гибридных интерферонов с большей, чем у родительских молекул, противораковой активностью.
9. Природный гормон роста человека связывается не только с рецептором этого гормона, но и с рецептором другого гормона - пролактина. Для того, чтобы избежать нежелательных побочных эффектов в процессе лечения, ученые решили устранить возможность присоединения гормона роста к пролактиновому рецептору. Они добились этого, заменив некоторые аминокислоты в первичной структуре гормона роста с помощью генетической инженерии.
10. Разрабатывая средства против ВИЧ-инфекции, ученые получили гибридный белок, один фрагмент которого обеспечивал специфическое связывание этого белка только с пораженными вирусом лимфоцитами, другой фрагмент осуществлял проникновение гибридного белка внутрь пораженной клетки, а еще один фрагмент нарушал синтез белка в пораженной клетке, что приводило к ее гибели.
Белки являются основной мишенью для лекарственных средств. Сейчас известно около 500 мишеней для действия лекарств. В ближайшие годы их число возрастет до 10 000, что позволит создать новые, более эффективные и безопасные лекарства. В последнее время разрабатываются принципиально новые подходы поиска лекарственных средств: в качестве мишеней рассматриваются не одиночные белки, а их комплексы, белок -белковые взаимодействия и фолдинг белков .
Заключение
Технология белковой инженерии используется (часто - в сочетании с методом рекомбинантных ДНК) для улучшения свойств существующих белков (ферментов, антител, клеточных рецепторов) и создания новых, не существующих в природе протеинов. Такие белки применяются для создания лекарственных препаратов, при обработке пищевых продуктов и в промышленном производстве.
В настоящее время наиболее популярной областью применения белковой инженерии является изменение каталитических свойств ферментов для разработки «экологически дружественных» промышленных процессов. С точки зрения охраны окружающей среды ферменты являются наиболее приемлемыми из всех катализаторов, используемых в промышленности. Это обеспечивается способностью биокатализаторов растворяться в воде и полноценно функционировать в среде с нейтральным рН и при сравнительно низких температурах. Кроме того, благодаря их высокой специфичности, в результате применения биокатализаторов образуется совсем немного нежелательных побочных продуктов производства. Экологически чистые и энергосберегающие промышленные процессы, использующие биокатализаторы, уже давно активно внедряются химической, текстильной, фармацевтической, целлюлозно-бумажной, пищевой, энергетической и других областях современной промышленности.
Однако некоторые характеристики биокатализаторов делают их использование в ряде случаев неприемлемым. Например, большинство ферментов распадается при повышении температуры. Ученые пытаются преодолеть подобные препятствия и увеличить стабильность ферментов в суровых условиях производства с помощью методов белковой инженерии.
Кроме промышленного применения, белковая инженерия нашла себе достойное место и в медицинских разработках. Исследователи синтезируют белки, способные связываться с вирусами и мутантными генами, вызывающими опухоли, и обезвреживать их; создают высокоэффективные вакцины и изучают белки-рецепторы клеточной поверхности, которые часто являются мишенями для фармацевтических препаратов. Ученые, занимающиеся усовершенствованием продуктов питания, используют белковую инженерию для улучшения качеств белков, обеспечивающих сохранность продуктов растительного происхождения, а также желирующих веществ или загустителей.
Еще одной областью применения белковой инженерии является создание белков, способных нейтрализовать вещества и микроорганизмы, которые могут быть использованы для химических и биологических атак. Например, ферменты гидролазы способны обезвреживать как нервнопаралитические газы, так и используемые в сельском хозяйстве пестициды. При этом производство, хранение и использование ферментов не опасно для окружающей среды и здоровья людей .
белок инженерия мутагенез модифицированный
Список литературы
1. Белковая инженерия.
2. Белковая инженерия. Загадки генетики. /Вячеслав Маркин // Тайны, загадки, факты.
3. Белковая инженерия. // Большая Российская энциклопедия.
4. Белковая инженерия. // Справочник химика 21.
5. Белковая инженерия и эффективность лекарств.
6. Белковая инженерия. / А.И. Корнелюк // Biopolymers and Cell.
7. Белковая инженерия повысит эффективность лекарств. // Популярная механика.
8. Белковая инженерия. Получение инсулина. // Биофайл - научно-информационный журнал.
9. Биотехнология. Основные направления и достижения. // Биология для абитуриентов и учителей.
10. Богданов А.А., Медников Б.М. Власть над геном / А. А. Богданов, Б.М. Медников - М.: Просвещение, 1989 - с.208
11. Генная инженерия. // Здравие.
12. Гены и химики. // Генетика.
13. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение / Б. Глик, Дж. Пастернак. -- М.: Мир, 2002.
14. Другие области применения генной инженерии. / Л.В. Тимощенко, М.В. Чубик // Медицина - новости и технологии.
15. Егорова Т.А., Клунова С.М., Живухин Е.А. Основы биотехнологии. / Т.А. Егорова, С.М. Клунова, Е.А. Живухин -- М., 2003.
16. Инженерия белка. // Химия и биотехнология.
17. Патрушев Л.И. Экспрессия генов/ Л.И. Патрушев - М.: Наука, 2000. - 496с.
18. Патрушев Л.И. Искусственные генетические системы. Т. 1: Генная и белковая инженерия. /Л.И. Патрушев - М.: Наука, 2004. - 526 с.
19. Рыбчин В.Н. Основы генетической инженерии: Учебник для вузов/В.Н. Рыбчин - СПб.: Изд-во СПбГТУ, 2002. - 522 с.
20. Степанов В.М. Молекулярная биология. Структуры и функции белков. / В.М. Степанов -- М.: Высшая Школа, 1996.
21. Технологии биотехнологии: белковая инженерия, нанобиотехнология, биосенсоры и биочипы. / Евгения Рябцева // «Коммерческая биотехнология» - интернет-журнал.
22. Чернавский Д.С., Чернавская Н.М. Белок--машина. Биологические макромолекулярные конструкции. / Д.С. Чернавский, Н. М. Чернавская -- М.: Изд-во МГУ, 1999.
23. Шульц Г.Е., Ширмер Р.Х. Принципы структурной организации белков. / Г.Е. Шульц, Р.Х. Ширмер -- М.: Мир, 1982.
24. Brannigan J.А., Wilkinson А.J. Protein engineering 20 years on // Nature Reviews. Molecular Cell Biology. 2002. Vol. 3. № 12;
25. Protein engineering. // Wikipedia, the free encyclopedia.
Размещено на Allbest.ru
Подобные документы
Суть и задачи генной инженерии, история ее развития. Цели создания генетически модифицированных организмов. Химическое загрязнение как следствие ГМО. Получение человеческого инсулина как важнейшее достижение в сфере генно-модифицированных организмов.
реферат , добавлен 18.04.2013
Возникновение биотехнологии. Основные направления биотехнологии. Биоэнергетика как раздел биотехнологии. Практические достижения биотехнологии. История генетической инженерии. Цели, методы и ферменты генной инженерии. Достижения генетической инженерии.
реферат , добавлен 23.07.2008
Возможности генной инженерии растений. Создание гербицидоустойчивых растений. Повышение эффективности фотосинтеза, биологической азотфиксации. Улучшение качества запасных белков. Экологические, медицинские и социально-экономические риски генной инженерии.
контрольная работа , добавлен 15.12.2011
Сущность генетической инженерии, методы идентификации трансгенных организмов; получение и технология ГМО, отличие от традиционной селекции, преимущества и недостатки. Состояние и перспективны развития рынка генетически модифицированных товаров в мире.
курсовая работа , добавлен 20.11.2010
Генная инженерия - метод биотехнологии, который занимается исследованиями по перестройке генотипов. Возможности генной инженерии. Перспективы генной инженерии. Уменьшение риска, связанного с генными технологиями.
реферат , добавлен 04.09.2007
Генная инженерия: история возникновения, общая характеристика, преимущества и недостатки. Знакомство с новейшими методами генной инженерии, их использование в медицине. Разработка генной инженерии в области животноводства и птицеводства. Опыты на крысах.
курсовая работа , добавлен 11.07.2012
Последовательность приемов генетической инженерии, используемая при создании генетически модифицированных организмов. Классификация основных типов рестриктаз, используемых для фрагментации ДНК. Ферменты, синтезирующие ДНК на матрице ДНК или РНК.
презентация , добавлен 27.04.2014
Сущность генной и клеточной инженерии. Основные задачи генной модификации растений, анализ вредности их употребления в пищу. Особенности гибридизации растительных и животных клеток. Механизм получения лекарственных веществ с помощью генной инженерии.
презентация , добавлен 26.01.2014
курсовая работа , добавлен 10.05.2011
Основы и техника клонирования ДНК. Этапы генной инженерии бактерий. Развитие генетической инженерии растений. Генетическая трансформация и улучшение растений с помощью агробактерий, источники генов. Безопасность генетически модифицированных растений.
Курсовая работа
по дисциплине: Сельскохозяйственная биотехнология
на тему: «Белковая инженерия»
Введение. Белковая инженерия
1 Понятие белковой инженерии. История развития
2 Стратегии белковой инженерии. Примеры инженерных белков. Применение белковой инженерии
1 Библиотеки пептидов и эпитопов
2 Белки-репортеры в гибридных белках
3 Некоторые достижения белковой инженерии.
Заключение
Список литературы
Реферат
Тема работы: Белковая инженерия.
Ключевые слова: биотехнология, генная инженерия, белок, генетический код, ген, ДНК, РНК, АТФ, пептиды, эпитоп.
Цель курсовой работы: изучение понятия «белковая инженерия» и потенциальных возможностей её использования.
Потенциальные возможности белковой инженерии:
Изменив прочность связывания преобразуемого вещества - субстрата - с ферментом, можно повысить общую каталитическую эффективность ферментативной реакции.
Повысив стабильность белка в широком диапазоне температур и кислотности среды, можно использовать его в условиях, при которых исходный белок денатурирует и теряет свою активность.
Создав белки, способные функционировать в безводных растворителях, можно осуществлять каталитические реакции в нефизиологических условиях.
Изменив каталитический центр фермента, можно повысить его специфичность и уменьшить число нежелательных побочных реакций
Повысив устойчивость белка к расщепляющим его ферментам, можно упростить процедуру его очистки.
Изменив белок таким образом, чтобы он мог функционировать без обычного для него не аминокислотного компонента (витамина, атома металла и т.п.), можно использовать его в некоторых непрерывных технологических процессах.
Изменив структуру регуляторных участков фермента, можно уменьшить степень его торможения продуктом ферментативной реакции по типу отрицательной обратной связи и тем самым увеличить выход продукта.
Можно создать гибридный белок, обладающий функциями двух и более белков.
Можно создать гибридный белок, один из участков которого облегчает выход гибридного белка из культивируемой клетки или извлечение его из смеси.
Введение
С незапамятных времен биотехнология применялась преимущественно в пищевой и легкой промышленности: в виноделии, хлебопечении, сбраживании молочных продуктов, при обработке льна и кож, основанных на применении микроорганизмов. В последние десятилетия возможности биотехнологии необычайно расширились. Это связано с тем, что ее методы выгоднее обычных по той простой причине, что в живых организмах биохимические реакции, катализируемые ферментами, идут при оптимальных условиях (температуре и давлении), более производительны, экологически чисты и не требуют химических реактивов, отравляющих среду .
Объектами биотехнологии являются многочисленные представители групп живых организмов - микроорганизмы (вирусы, бактерии, простейшие, дрожжевые грибы), растения, животные, а также изолированные из них клетки и субклеточные компоненты (органеллы) и даже ферменты. Биотехнология базируется на протекающих в живых системах физиолого-биохимических процессах, в результате которых осуществляются выделение энергии, синтез и расщепление продуктов метаболизма, формирование химических и структурных компонентов клетки.
Главным направлением биотехнологии является производство с помощью микроорганизмов и культивируемых эукариотических клеток биологически активных соединений (ферменты, витамины, гормоны), лекарственных препаратов (антибиотики, вакцины, сыворотки, высокоспецифичные антитела и др.), а также ценных соединений (кормовые добавки, например, незаменимые аминокислоты, кормовые белки и т. д.).
Методы генетической инженерии позволили осуществить синтез в промышленных количествах таких гормонов, как инсулин и соматотропин (гормон роста), которые необходимы для лечения генетических болезней человека.
Биотехнология решает не только конкретные задачи науки и производства. У нее есть более глобальная методологическая задача - она расширяет и ускоряет масштабы воздействия человека на живую природу и способствует адаптации живых систем к условиям существования человека, т. е. к ноосфере. Биотехнология, таким образом, выступает в роли мощного фактора антропогенной адаптивной эволюции.
У биотехнологии, генетической и клеточной инженерии многообещающие перспективы. При появлении все новых и новых векторов человек с их помощью будет внедрять нужные гены в клетки растений, животных и человека. Это позволит постепенно избавиться от многих наследственных болезней человека, заставить клетки синтезировать необходимые лекарства и биологически активные соединения, а затем - непосредственно белки и незаменимые аминокислоты, употребляемые в пищу. Используя методы, уже освоенные природой, биотехнологи надеются получать с помощью фотосинтеза водород - самое экологически чистое топливо будущего, электроэнергию, превращать в аммиак атмосферный азот при обычных условиях .
Физические и химические свойства природных белков часто не удовлетворяют условиям, в которых эти белки будут использоваться человеком. Требуется изменение его первичной структуры, которое обеспечит формирование белка с иной, чем прежде, пространственной структурой и новыми физико-химическими свойствами, позволяющими и в иных условиях выполнять присущие природному белку функции. Конструированием белков занимается белковая инженерия .
Еще одной областью применения белковой инженерии является создание белков, способных нейтрализовать вещества и микроорганизмы, которые могут быть использованы для химических и биологических атак. Например, ферменты гидролазы способны обезвреживать как нервнопаралитические газы, так и используемые в сельском хозяйстве пестициды. При этом производство, хранение и использование ферментов не опасно для окружающей среды и здоровья людей.
Для получения измененного белка используют методы комбинаторной химии и осуществляют направленный мутагенез - внесение специфических изменений в кодирующие последовательности ДНК, приводящие к определенным изменениям в аминокислотных последовательностях. Для эффективного конструирования белка с заданными свойствами необходимо знать закономерности формирования пространственной структуры белка, от которой зависят его физико-химические свойства и функции, то есть необходимо знать, как первичная структура белка, каждый его аминокислотный остаток влияет на свойства и функции белка. К сожалению, для большинства белков неизвестна третичная структура, не всегда бывает известно, какую именно аминокислоту или последовательность аминокислот нужно изменить, чтобы получить белок с нужными свойствами. Уже сейчас ученые с помощью компьютерного анализа могут предсказывать свойства многих белков, исходя из последовательности их аминокислотных остатков. Подобный анализ значительно упростит процедуру создания нужных белков. Пока же для того, чтобы получить измененный белок с нужными свойствами, идут в основном иным путем: получают несколько мутантных генов и находят тот белковый продукт одного из них, который обладает нужными свойствами.
Для направленного мутагенеза используют разные экспериментальные подходы. Получив измененный ген, его встраивают в генетическую конструкцию и вводят ее в прокариотические или эукариотические клетки, осуществляющие синтез белка, кодируемого этой генетической конструкцией .
I. Белковая инженерия
1 Понятие белковой инженерии. История развития
Белковая инженерия (англ. Protein engineering) - раздел биотехнологии, который занимается разработкой полезных или ценных белков. Это относительно новая дисциплина, которая направлена на исследование фолдинга белков и принципов модификации и создания белков.
Существуют две основные стратегии для белковой инженерии: направленная модификация белка и направленная эволюция. Эти методы не являются взаимоисключающими; исследователи часто применяют оба. В будущем, более детальное знание структуры и функции белков, а также достижения в области высоких технологий, может значительно расширить возможности белковой инженерии. В итоге, даже неприродные аминокислоты могут быть включены благодаря новому методу, который позволяет включать новые аминокислоты в генетический код .
Белковая инженерия зародилась на стыке физики и химии белка и генетической инженерии. Она решает задачу создания модифицированных или гибридных молекул белков с заданными характеристиками. Естественным путем реализации такой задачи является предсказание структуры гена, кодирующего измененный белок, осуществление его синтеза, клонирования и экспрессии в реципиентных клетках .
Первая контролируемая модификация белка была проведена в середине 60-х годов Кошландом и Бендером. Для замены гидроксильной группы на сульфгидрильную в активном центре протеазы - субтилизина они применили метод химической модификации. Однако, как выяснилось, такой тиолсубтилизин не сохраняет протеазную активность.
Белок в химическом отношении представляет собой однотипную молекулу, которая является полиаминокислотной цепочкой или полимером. Составлен он из аминокислотных последовательностей 20 типов. Узнав строение белков, люди задались вопросом: можно ли спроектировать абсолютно новые аминокислотные последовательности, чтобы они выполняли нужные человеку функции гораздо лучше, чем обычные белки? Для данной идеи подошло название Белковая инженерия .
О такой инженерии стали задумываться ещё в 50-е годы XX столетия. Случилось это сразу же после расшифровки первых белковых аминокислотных последовательностей. Во многих лабораториях мира начали делать попытки дублировать природу и синтезировать химическим путём заданные абсолютно произвольно полиаминокислотные последовательности.
Больше всех в этом преуспел химик Б. Меррифилд. Этому американцу удалось разработать чрезвычайно эффективный метод синтеза полиаминокислотных цепей. За это Меррифилду в 1984 году присудили Нобелевскую премию по химии.
Рисунок 1. Схема функционирования белковой инженерии
Американец начал синтезировать короткие пептиды, включая гормоны. При этом построил автомат - «химического робота» - в задачу которого входило производит искусственные белки. Робот вызвал сенсацию в научных кругах. Однако скоро выяснилось, что его продукция не может конкурировать с тем, что производит природа.
Робот не мог в точности воспроизводить аминокислотные последовательности, то есть ошибался. Он синтезировал одну цепь с одной последовательностью, а другую уже с немного изменённой. В клетке же все молекулы одного белка идеально похожи друг на друга, то есть их последовательности абсолютно одинаковые.
Была и другая проблема. Даже те молекулы, которые робот синтезировал правильно, не принимали ту пространственную форму, которая необходима для функционирования фермента. Таким образом, попытка подменить природу обычными методами органической химии привела к весьма скромному успеху.
Учёным оставалось учиться у природы, выискивая нужные модификации белков. Тут дело в том, что в природе постоянно идут мутации, ведущие к изменению аминокислотных последовательностей белков. Если отобрать мутантов с необходимыми свойствами, более эффективно перерабатывающих тот или иной субстрат, то можно выделить из такого мутанта измененный фермент, благодаря которому клетка приобретает новые свойства. Но данный процесс занимает очень большой период времени.
Все изменилось тогда, когда появилась генная инженерия. Благодаря ей, стали создавать искусственные гены с любой последовательностью нуклеотидов. Эти гены встраивали в приготовленные молекулы-векторы и внедряли эти ДНК в бактерии или дрожжи. Там с искусственного гена снималась копия РНК. В результате этого вырабатывался нужный белок. Ошибки в его синтезе исключались. Главное, надо было подобрать нужную последовательность ДНК, а дальше уже ферментная система клетки сама безупречно делала своё дело. Таким образом, можно заключить, что генная инженерия открыла путь белковой инженерии в самой радикальной форме .
1.2 Стратегии белковой инженерии
Направленная модификация белка. При направленной модификации белка ученый использует детальное знание структуры и функции белка, чтобы внести нужные изменения. Как правило, этот метод имеет то преимущество, что он недорогой и технически несложный, так как техника сайт-направленного мутагенеза хорошо развита. Однако, его основным недостатком является то, что сведения о подробной структуре белка часто отсутствуют, и даже когда структура известна, может быть очень трудно предсказать влияние различных мутаций.
Программные алгоритмы модификации белка стремятся к выявлению новых аминокислотных последовательностей, которые требуют мало энергии для формирования предопределенной целевой структуры. В то время как последовательность, которая должно быть найдена, велика, наиболее сложным требованием для модификации белка является быстрый, но точный, способ для выявления и определения оптимальной последовательности, в отличие ее от аналогичных субоптимальных последовательностей .
Направленная эволюция. В направленной эволюции случайный мутагенез применяется к белку и селекция идет так, чтобы выбрать варианты, которые имеют определенные качества. Далее применяются еще раунды мутации и селекции. Этот метод имитирует естественную эволюцию и в целом позволяет получить превосходные результаты для направленной модификации.
Дополнительный метод, известный как ДНК-перетасовки, смешивает и выявляет части удачных вариантов для получения лучших результатов. Этот процесс имитирует рекомбинации, которые происходят естественно во время полового размножения. Преимуществом направленной эволюции является то, что она не требует предварительных знаний о структуре белка, да и не нужно, чтобы иметь возможность прогнозировать, какое влияние данная мутация будет иметь. В самом деле, результаты экспериментов направленной эволюции удивляют, поскольку желаемые изменения часто бывают вызваны мутациями, которые не должны были иметь такой эффект. Недостатком является то, что этот метод требует высокой пропускной способности, который не представляется возможным для всех белков. Большое количество рекомбинантной ДНК должно быть мутированным и необходимо провести скрининг продуктов на выявление желаемого качества. Огромное количество вариантов часто требует покупки робототехники для автоматизации процесса. Кроме того, не всегда легко провести скрининг на выявление всех интересующих качеств .
II. Примеры инженерных белков
Белковая инженерия может быть основана на химической модификации готового белка или на методах генетической инженерии, позволяющих получать модифицированные варианты природных белков .
Конструирование определенного биологического катализатора ведется с учетом как специфичности белка, так и каталитической активности металлоорганического комплекса. Вот примеры такой модификации, проведенной для получения «полусинтетических биоорганических комплексов». Миоглобин кашалота способен связывать кислород, но не обладает биокаталитической активностью. В результате объединения этой биомолекулы с тремя электрон-переносящими комплексами, содержащими рутений, которые связываются с остатками гистидина на поверхности молекул белка, образуется комплекс, способный восстанавливать кислород при одновременном окислении ряда органических субстратов, например аскорбата, со скоростью почти такой же, как для природной аскорбатоксидазы. В принципе белки можно модифицировать и другими способами. Рассмотрим, например, папаин. Он относится к числу хорошо изученных протеолитических ферментов, для которого определена трехмерная структура. Поблизости от остатка цистеина-25 на поверхности белковой молекулы располагается протяженный желобок, в котором протекает реакция протеолиза. Этот участок может быть алкилирован производным флавина без изменения доступности участка связывания потенциальных субстратов. Такие модифицированные флавопапаины использовались для окисления М-алкил-1,4-дигидроникотинамидов, и каталитическая активность некоторых из этих модифицированных белков была существенно выше, чем у природных флавопротеин-NADH-дегидрогеназ. Таким образом удалось создать очень эффективный полусинтетический фермент. Использование флавинов с высокоактивными, находящимися в определенном положении электрон-оттягивающими заместителями, возможно, позволит разработать эффективные катализаторы для восстановления никотин-амида.
Крупные успехи, достигнутые за последнее время в химическом синтезе ДНК, открыли перед белковой инженерией принципиально новые возможности: конструирование уникальных, не встречающихся в природе белков. Для этого необходимо и дальнейшее развитие технологии, так чтобы изменение генов методами генетической инженерии приводило к предсказуемым изменениям белков, к улучшению вполне определенных функциональных их характеристик: числа оборотов, Км для конкретного субстрата, термостабильности, температурного оптимума, стабильности и активности в неводных растворителях, субстратной и реакционной специфичности, потребности в кофакторах, оптимуме рН, устойчивости к протеазам, аллостерической регуляции, молекулярной массы и субъединичного строения. Обычно такого улучшения достигали с помощью мутагенеза и отбора, а в последнее время - путем химической модификации и иммобилизации. Для успешного конструирования конкретного типа молекул белка необходимо выявить ряд основополагающих закономерностей, связывающих структурные особенности белков и их желаемые свойства. Так, зная точную кристаллическую структуру молекулы изучаемого белка, можно идентифицировать те ее участки, которые следует направленно модифицировать для увеличения его каталитической активности. Такая модификация может состоять в изменении аминокислотной последовательности белка .
Ещё одним примером может служить осуществление сайт-специфического мутагенеза. Он происходит следующим образом. Клонируют ген того белка, который интересует исследователя, и встраивают его в подходящий генетический носитель. Затем синтезируют олигонуклеотидную затравку с желаемой мутацией, последовательность которой из десяти - пятнадцати нуклеотидов в достаточной степени гомологична определенному участку природного гена и поэтому способна образовывать с ним гибридную структуру. Эта синтетическая затравка используется полимеразами для начала синтеза комплементарной копии вектора, которую затем отделяют от оригинала и используют для контролируемого синтеза мутантного белка. Альтернативный подход основан на расщеплении цепи, удалении подлежащего изменению сайта и замещении его синтетическим аналогом с желаемой последовательностью нуклеотидов.
Тирозил-тРНК-синтетаза катализирует реакцию аминоацилирования тирозиновой тРНК, которая включает активирование тирозина с помощью АТР с образованием тирозиладенилата. Ген этого фермента, выделенный из Bacillus stearothermophilus, был встроен в бактериофаг М13. Затем каталитические свойства фермента, особенно его способность связывать субстрат, были изменены путем сайт-специфической модификации. Так, треонин-51 был заменен на аланин. Это привело к двукратному увеличению связывания субстрата, видимо, из-за невозможности образования водородной связи между этим остатком и тирозил-аденилатом. При замене аланина пролином нарушается конфигурация молекулы фермента, но способность к связыванию субстрата увеличивается в сто раз, так как облегчается его взаимодействие с гистидином-48. Сходные сайт-специфичные изменения, были получены в р-лактамазе, и обычно они сопровождались инактивацией фермента. Замена серина-70 на цистеин приводит к образованию р-тиоллактамазы, константа связывания у которой не отличается от таковой для природного фермента, но активность по отношению к пенициллину составляет всего 1-2%. Тем не менее активность этого мутантного фермента в отношении некоторых активированных цефалоспоринов не меньше исходной активности или даже превышает ее; эти белки также более устойчивы к действию протеаз.
Мутации, вызываемые путем сайт-специфичного воздействия, используют сегодня для проверки адекватности результатов структурных исследований. В некоторых случаях с их помощью удалось показать, что структурная стабильность белка и его каталитическая активность могут быть разобщены. Накопилось достаточное количество информации о взаимосвязи между стабильностью структуры белка и его функцией, мы, возможно, сумеем осуществлять тонкую регуляцию активности биологических катализаторов и создавать полностью синтетические их аналоги. Недавно появилась работа, в которой сообщалось о клонировании первого синтетического гена фермента, кодирующего активный фрагмент молекулы рибонуклеазы .
III. Применение белковой инженерии
В настоящее время наиболее популярной областью применения белковой инженерии является изменение каталитических свойств ферментов для разработки «экологически дружественных» промышленных процессов. С точки зрения охраны окружающей среды ферменты являются наиболее приемлемыми из всех катализаторов, используемых в промышленности. Это обеспечивается способностью биокатализаторов растворяться в воде и полноценно функционировать в среде с нейтральным рН и при сравнительно низких температурах. Кроме того, благодаря их высокой специфичности, в результате применения биокатализаторов образуется совсем немного нежелательных побочных продуктов производства. Экологически чистые и энергосберегающие промышленные процессы, использующие биокатализаторы, уже давно активно внедряются химической, текстильной, фармацевтической, целлюлозно-бумажной, пищевой, энергетической и других областях современной промышленности.
Однако некоторые характеристики биокатализаторов делают их использование в ряде случаев неприемлемым. Например, большинство ферментов распадается при повышении температуры. Ученые пытаются преодолеть подобные препятствия и увеличить стабильность ферментов в суровых условиях производства с помощью методов белковой инженерии .
Кроме промышленного применения, белковая инженерия нашла себе достойное место и в медицинских разработках. Исследователи синтезируют белки, способные связываться с вирусами и мутантными генами, вызывающими опухоли, и обезвреживать их; создают высокоэффективные вакцины и изучают белки-рецепторы клеточной поверхности, которые часто являются мишенями для фармацевтических препаратов. Ученые, занимающиеся усовершенствованием продуктов питания, используют белковую инженерию для улучшения качеств белков, обеспечивающих сохранность продуктов растительного происхождения, а также желирующих веществ или загустителей.
Еще одной областью применения белковой инженерии является создание белков, способных нейтрализовать вещества и микроорганизмы, которые могут быть использованы для химических и биологических атак. Например, ферменты гидролазы способны обезвреживать как нервнопаралитические газы, так и используемые в сельском хозяйстве пестициды. При этом производство, хранение и использование ферментов не опасно для окружающей среды и здоровья людей .
3.1 Библиотеки пептидов и эпитопов
В живом организме большинство биологических процессов управляется посредством специфических белок-белковых или белково-нуклеиновых взаимодействий. К таким процессам относятся, например регуляция транскрипции генов под действием различных белковых факторов, взаимодействие белковых лигандов с рецепторами на поверхности клеток, а также специфическое связывание антигенов соответствующими антителами. Понимание молекулярных механизмов взаимодействия белковых лигандов с рецепторами имеет большое фундаментальное и прикладное значение. В частности, разработка новых лекарственных препаратов белковой природы обычно начинается с идентификации исходной последовательности аминокислот, обладающей требуемой биологической активностью (так называемая "основная" (lead) последовательность). Однако пептиды с основной последовательностью аминокислот могут обладать и нежелательными биологическими свойствами: низкой активностью, токсичностью, малой стабильностью в организме и т.п.
До появления библиотек пептидов улучшение их биологических свойств осуществляли путем последовательного синтеза большого числа аналогов и проверкой их биологической активности, что требовало больших затрат времени и средств. В последние годы появилась возможность с помощью автоматических синтезаторов создавать за короткое время тысячи различных пептидов. Разработанные методы направленного мутагенеза также позволили резко расширить число белков, получаемых одновременно и последовательно тестируемых на биологическую активность. Однако только недавно разработанные подходы к созданию библиотек пептидов привели к получению миллионов последовательностей аминокислот, требуемых для проведения эффективного скрининга с целью выявления среди них пептидов, максимально удовлетворяющих предъявляемым критериям. Такие библиотеки используются для исследования взаимодействия антител с антигенами, получения новых ингибиторов ферментов и антимикробных агентов, конструирования молекул, обладающих требуемой биологической активностью, или придания новых свойств белкам, например антителам .
По способам получения библиотеки пептидов разделяются на три группы. К первой группе можно отнести библиотеки, полученные с использованием химического синтеза пептидов, в которых индивидуальные пептиды иммобилизованы на микроносителях. При таком подходе после присоединения очередных аминокислот в индивидуальных реакционных смесях к пептидам, иммобилизованным на микроносителях, содержимое всех реакционных смесей объединяют и разделяют на новые порции, которые используют на следующей стадии присоединения новых аминокислотных остатков. После проведения ряда таких этапов оказываются синтезированными пептиды, содержащие последовательности использованных в синтезе аминокислот во всевозможных случайных сочетаниях.
Библиотеки пептидов, иммобилизованных на микроносителях, обладают существенным недостатком: они требуют при скрининге использования очищенных рецепторов, находящихся в растворимой форме. В то же время в большинстве случаев при биологических испытаниях, проводящихся для фундаментальных и фармакологических исследований, чаще всего находят применение рецепторы, ассоциированные с мембранами. По второму способу библиотеки пептидов получают с помощью твердофазного синтеза пептидов, при котором на каждой стадии химического присоединения очередной аминокислоты к растущим пептидным цепям используют эквимолярные смеси всех или некоторых аминокислот-предшественников. На конечной стадии синтеза проводят отделение пептидов от носителя, т.е. перевод их в растворимую форму. Третий подход к конструированию библиотек пептидов, к описанию которого мы сейчас переходим, стал реальным именно благодаря развитию методов генной инженерии. Он прекрасно иллюстрирует возможности таких методов и, несомненно, является крупным достижением в их применении. В этой связи рассмотрим более подробно результаты использования библиотек пептидов в исследовании эпитопов (антигенных детерминант) белков .
Генно-инженерная технология получения гибридных белков позволила разработать эффективный метод наработки коротких пептидов для анализа их биологической активности. Как и в случае клонотек генов, библиотеки пептидов, полученные генно-инженерными методами, представляют собой большой (часто исчерпывающий) набор коротких пептидов. Два недавно сделанных наблюдения позволяют рассматривать библиотеку пептидов одновременно и в качестве библиотеки эпитопов белков. Во-первых, короткие пептиды могут включать все основные остатки аминокислот, играющие главную роль во взаимодействии с антителами, и они в состоянии имитировать крупные антигенные детерминанты белков. Во-вторых, в большинстве случаев нековалентные связи, образуемые между немногими наиболее важными остатками аминокислот белковых лигандов и их рецепторами, вносят основной вклад в общую энергию взаимодействия лиганд-рецептор. С учетом этого любой пептид можно рассматривать как потенциальный лиганд, гаптен или часть антигенной детерминанты более крупных полипептидов, а любую библиотеку пептидов - как библиотеку эпитопов белков или потенциальных лигандов для соответствующих белковых рецепторов.
Библиотека пептидов, полученная в результате реализации третьего подхода, в современном виде представляет собой набор десятков или даже сотен миллионов коротких различающихся последовательностей аминокислот, которые экспрессированы на поверхности вирионов бактериофагов в составе их собственных структурных белков. Это становится возможным благодаря введению методами генной инженерии в геном бактериофагов гибридных рекомбинантных генов, кодирующих измененные структурные белки его вирионов. (Данный метод известен под названием фагового дисплея.) В результате экспрессии таких генов образуются гибридные белки, на N- или С-концах которых присутствуют дополнительные последовательности аминокислот.
Библиотеки пептидов и эпитопов найдут свое применение и в исследованиях механизмов гуморального иммунного ответа, а также заболеваний иммунной системы. В частности, большинство аутоиммунных заболеваний сопровождается образованием аутоантител против антигенов собственного организма. Эти антитела во многих случаях служат специфическими маркерами того или иного аутоиммунного заболевания. С использованием библиотеки эпитопов, в принципе, можно получить пептидные маркеры, с помощью которых было бы возможно следить за специфичностью аутоантител во время развития патологического процесса как в индивидуальном организме, так и в группе пациентов и, кроме того, определять специфичность аутоантител при заболеваниях неизвестной этиологии.
Библиотеки пептидов и эпитопов потенциально могут быть использованы также для скрининга иммунных сывороток с целью выявления пептидов, специфически взаимодействующих с защитными антителами. Такие пептиды будут имитировать антигенные детерминанты патогенных организмов и служить мишенями для защитных антител организма. Это позволит использовать подобные пептиды для вакцинации пациентов, у которых отсутствуют антитела против соответствующих патогенов. Изучение эпитопов с помощью библиотек пептидов является частным случаем одного из многочисленных направлений их использования в прикладных и фундаментальных исследованиях взаимодействия лигандов и рецепторов. Дальнейшее усовершенствование этого подхода должно способствовать созданию новых лекарственных препаратов на основе коротких пептидов и быть полезным в фундаментальных исследованиях механизмов белок-белковых взаимодействий .
3.2 Белки-репортеры в гибридных белках
В другом случае гибридные белки применяют для получения высокого уровня экспрессии коротких пептидов в бактериальных клетках благодаря стабилизации этих пептидов в составе гибридных белков. Часто гибридные белки используют для идентификации и очистки трудноопределяемых рекомбинантных белков. Например, присоединив к С-концу исследуемого белка в качестве белка-репортера галактозидазу, можно производить очистку рекомбинантного белка по активности галактозидазы, определяя ее антигенные детерминанты иммунохимическими методами. Соединяя фрагменты ДНК, содержащие открытые рамки считывания (ОРС), с генами белков-репортеров, можно очистить такие гибридные белки по активности белка-репортера и использовать их для иммунизации лабораторных животных. Полученные антитела далее применяют для очистки нативного белка, в состав которого входит рекомбинантный полипептид, кодируемый ОРС, и тем самым идентифицируют клонированный фрагмент гена .
С помощью гибридных белков решают и обратную задачу клонирования неизвестного гена, к белковому продукту которого имеются антитела. В таком случае конструируют клонотеку последовательностей нуклеотидов, представляющих ОРС неизвестных генов, в векторах, которые позволяют соединять клонируемую ОРС в одной рамке считывания с геном-репортером. Образующиеся в результате экспрессии этих рекомбинантных генов гибридные белки идентифицируются с помощью антител иммуноферментными методами. Гибридные гены, объединяющие секретируемые белки и белки-репортеры, дают возможность по-новому исследовать механизмы секреции, а также локализацию и перемещение в тканях секретируемых белков .
3.3 Некоторые достижения белковой инженерии
Заменив несколько аминокислотных остатков лизоцима бактериофага Т4 на цистеин получен фермент с большим числом дисульфидных связей, благодаря чему этот фермент сохранил свою активность при более высокой температуре.
Замена остатка цистеина на остаток серина в молекуле р-интерферона человека, синтезируемого кишечной палочкой, предотвращала образование межмолекулярных комплексов, при котором примерно в 10 раз уменьшалась противовирусная активность этого лекарственного средства.
Замена остатка треонина на остаток пролина в молекуле фермента тирозил-тРНК-синтетазы повысило каталитическую активность этого фермента в десятки раз: он стал быстрее присоединять тирозин к тРНК, переносящей эту аминокислоту в рибосому в ходе трансляции.
Субтилизины - богатые серином ферменты, расщепляющие белки. Они секретируются многими бактериями и широко используются человеком для биодеградации. Они прочно связывают атомы кальция, повышающие их стабильность. Однако в промышленных процессах присутствуют химические соединения, которые связывают кальций, после чего субтилизины теряют свою активность. Изменив ген, ученые удалили из фермента аминокислоты, участвующие в связывании кальция, и заменили одну аминокислоту на другую с целью повышения стабильности субтилизина. Измененный фермент оказался стабильным и функционально активным в условиях, близких к промышленным.
Была показана возможность создания фермента, функционирующего по типу рестриктаз, расщепляющих ДНК в строго определенных местах. Ученые создали гибридный белок, один фрагмент которого узнавал определенную последовательность нуклеотидных остатков в молекуле ДНК, а другой расщеплял ДНК в этом участке.
Активатор тканевого плазминогена - фермент, который используют в клинике для растворения сгустков крови. К сожалению, он быстро выводится из системы кровообращения и его приходится вводить повторно или в больших дозах, что приводит к побочным эффектам. Внеся три направленные мутации в ген этого фермента, получили долгоживущий фермент, обладающий повышенным сродством к разрушаемому фибрину и с такой же фибринолитической активностью, как у исходного фермента.
Произведя замену одной аминокислоты в молекуле инсулина, ученые добились того, что при подкожном введении этого гормона больным, страдающим диабетом, изменение концентрации этого гормона в крови было близко к физиологическому, возникающему после приема пищи.
Существует три класса интерферонов, обладающих противовирусной и противораковой активностью, но проявляющих разную специфичность. Заманчиво было создать гибридный интерферон, обладающий свойствами интерферонов трех типов. Были созданы гибридные гены, включающие в себя фрагменты природных генов интерферонов нескольких типов. Часть этих генов, будучи встроенными в бактериальные клетки, обеспечивали синтез гибридных интерферонов с большей, чем у родительских молекул, противораковой активностью.
Природный гормон роста человека связывается не только с рецептором этого гормона, но и с рецептором другого гормона - пролактина. Для того, чтобы избежать нежелательных побочных эффектов в процессе лечения, ученые решили устранить возможность присоединения гормона роста к пролактиновому рецептору. Они добились этого, заменив некоторые аминокислоты в первичной структуре гормона роста с помощью генетической инженерии.
Разрабатывая средства против ВИЧ-инфекции, ученые получили гибридный белок, один фрагмент которого обеспечивал специфическое связывание этого белка только с пораженными вирусом лимфоцитами, другой фрагмент осуществлял проникновение гибридного белка внутрь пораженной клетки, а еще один фрагмент нарушал синтез белка в пораженной клетке, что приводило к ее гибели.
Белки являются основной мишенью для лекарственных средств. Сейчас известно около 500 мишеней для действия лекарств. В ближайшие годы их число возрастет до 10 000, что позволит создать новые, более эффективные и безопасные лекарства. В последнее время разрабатываются принципиально новые подходы поиска лекарственных средств: в качестве мишеней рассматриваются не одиночные белки, а их комплексы, белок -белковые взаимодействия и фолдинг белков .
Заключение
Технология белковой инженерии используется (часто - в сочетании с методом рекомбинантных ДНК) для улучшения свойств существующих белков (ферментов, антител, клеточных рецепторов) и создания новых, не существующих в природе протеинов. Такие белки применяются для создания лекарственных препаратов, при обработке пищевых продуктов и в промышленном производстве.
В настоящее время наиболее популярной областью применения белковой инженерии является изменение каталитических свойств ферментов для разработки «экологически дружественных» промышленных процессов. С точки зрения охраны окружающей среды ферменты являются наиболее приемлемыми из всех катализаторов, используемых в промышленности. Это обеспечивается способностью биокатализаторов растворяться в воде и полноценно функционировать в среде с нейтральным рН и при сравнительно низких температурах. Кроме того, благодаря их высокой специфичности, в результате применения биокатализаторов образуется совсем немного нежелательных побочных продуктов производства. Экологически чистые и энергосберегающие промышленные процессы, использующие биокатализаторы, уже давно активно внедряются химической, текстильной, фармацевтической, целлюлозно-бумажной, пищевой, энергетической и других областях современной промышленности.
Однако некоторые характеристики биокатализаторов делают их использование в ряде случаев неприемлемым. Например, большинство ферментов распадается при повышении температуры. Ученые пытаются преодолеть подобные препятствия и увеличить стабильность ферментов в суровых условиях производства с помощью методов белковой инженерии.
Кроме промышленного применения, белковая инженерия нашла себе достойное место и в медицинских разработках. Исследователи синтезируют белки, способные связываться с вирусами и мутантными генами, вызывающими опухоли, и обезвреживать их; создают высокоэффективные вакцины и изучают белки-рецепторы клеточной поверхности, которые часто являются мишенями для фармацевтических препаратов. Ученые, занимающиеся усовершенствованием продуктов питания, используют белковую инженерию для улучшения качеств белков, обеспечивающих сохранность продуктов растительного происхождения, а также желирующих веществ или загустителей.
Еще одной областью применения белковой инженерии является создание белков, способных нейтрализовать вещества и микроорганизмы, которые могут быть использованы для химических и биологических атак. Например, ферменты гидролазы способны обезвреживать как нервнопаралитические газы, так и используемые в сельском хозяйстве пестициды. При этом производство, хранение и использование ферментов не опасно для окружающей среды и здоровья людей .
белок инженерия мутагенез модифицированный
Список литературы
1.Белковая инженерия.
2.Белковая инженерия. Загадки генетики. /Вячеслав Маркин // Тайны, загадки, факты.
Белковая инженерия. // Большая Российская энциклопедия.
Белковая инженерия. // Справочник химика 21.
Белковая инженерия и эффективность лекарств.
Белковая инженерия. / А.И. Корнелюк // Biopolymers and Cell.
Белковая инженерия повысит эффективность лекарств. // Популярная механика.
Белковая инженерия. Получение инсулина. // Биофайл - научно-информационный журнал.
Биотехнология. Основные направления и достижения. // Биология для абитуриентов и учителей.
Богданов А.А., Медников Б.М. Власть над геном / А. А. Богданов, Б.М. Медников - М.: Просвещение, 1989 - с.208
Генная инженерия. // Здравие.
Гены и химики. // Генетика.
13.Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение / Б. Глик, Дж. Пастернак. - М.: Мир, 2002.
14.Другие области применения генной инженерии. / Л.В. Тимощенко, М.В. Чубик // Медицина - новости и технологии.
15.Егорова Т.А., Клунова С.М., Живухин Е.А. Основы биотехнологии. / Т.А. Егорова, С.М. Клунова, Е.А. Живухин - М., 2003.
16.Инженерия белка. // Химия и биотехнология.
17.Патрушев Л.И. Экспрессия генов/ Л.И. Патрушев - М.: Наука, 2000. - 496с.
Патрушев Л.И. Искусственные генетические системы. Т. 1: Генная и белковая инженерия. /Л.И. Патрушев - М.: Наука, 2004. - 526 с.
Рыбчин В.Н. Основы генетической инженерии: Учебник для вузов/В.Н. Рыбчин - СПб.: Изд-во СПбГТУ, 2002. - 522 с.
Степанов В.М. Молекулярная биология. Структуры и функции белков. / В.М. Степанов - М.: Высшая Школа, 1996.
Технологии биотехнологии: белковая инженерия, нанобиотехнология, биосенсоры и биочипы. / Евгения Рябцева // «Коммерческая биотехнология» - интернет-журнал.
Чернавский Д.С., Чернавская Н.М. Белок-машина. Биологические макромолекулярные конструкции. / Д.С. Чернавский, Н. М. Чернавская - М.: Изд-во МГУ, 1999.
Шульц Г.Е., Ширмер Р.Х. Принципы структурной организации белков. / Г.Е. Шульц, Р.Х. Ширмер - М.: Мир, 1982.
24.Brannigan J.А., Wilkinson А.J. Protein engineering 20 years on // Nature Reviews. Molecular Cell Biology. 2002. Vol. 3. № 12;
25.Protein engineering. // Wikipedia, the free encyclopedia.
В рассмотренных выше библиотеках пептидов последние ковалентно связаны с белком-носителем. В таком виде они являются одними из представителей гибридных белков, получаемых методами генной инженерии.
В другом случае гибридные белки применяют для получения высокого уровня экспрессии коротких пептидов в бактериальных клетках благодаря стабилизации этих пептидов в составе гибридных белков. Часто гибридные белки используют для идентификации и очистки трудноопределяемых рекомбинантных белков. Например, присоединив к С-концу исследуемого белка в качестве белка-репортера -галактозидазу, можно производить очистку рекомбинантного белка по активности -галактозидазы, определяя ее антигенные детерминанты иммунохимическими методами. Соединяя фрагменты ДНК, содержащие открытые рамки считывания (ОРС), с генами белков-репортеров, можно очистить такие гибридные белки по активности белка-репортера и использовать их для иммунизации лабораторных животных. Полученные антитела далее применяют для очистки нативного белка, в состав которого входит рекомбинантный полипептид, кодируемый ОРС, и тем самым идентифицируют клонированный фрагмент гена.
С помощью гибридных белков решают и обратную задачу клонирования неизвестного гена, к белковому продукту которого имеются антитела. В таком случае конструируют клонотеку последовательностей нуклеотидов, представляющих ОРС неизвестных генов, в векторах, которые позволяют соединять клонируемую ОРС в одной рамке считывания с геном-репортером. Образующиеся в результате экспрессии этих рекомбинантных генов гибридные белки идентифицируются с помощью антител иммуноферментными методами. Гибридные гены, объединяющие секретируемые белки и белки-репортеры, дают возможность по-новому исследовать механизмы секреции, а также локализацию и перемещение в тканях секретируемых белков.
Гибридные токсины
Серия работ И. Пастана с сотрудниками по конструированию гибридных токсинов направленного действия прекрасно иллюстрирует возможности белковой инженерии в части комбинирования различных функциональных доменов белков для достижения конкретных биологических эффектов.
Рис. II.22. Лекарственные препараты направленного действия на основе гибридных токсинов
а – обобщенная схема структуры лекарственного препарата направленного действия;б – строение псевдомонадного токсина (цифрами обозначено положение аминокислотных остатков);в – строение гибридного токсина;г – гибридный токсин на основе моноклональных антител
Идеальное лекарственное средство строго специфического избирательного действия должно обладать, по крайней мере, следующими структурно-функциональными особенностями (рис. II.22,а ). Такой лекарственный препарат должен заключать в себе действующее начало для достижения физиологического эффекта и лиганд, распознающий рецептор на поверхности клеток-мишеней. Кроме того, в нем должны быть структурные элементы, распознаваемые системой транспорта организма, для доставки лекарства к клеткам-мишеням, а также спейсерный участок, необходимый для отделения действующего начала от остальных функциональных частей препарата после его доставки по адресу. Именно такая идеальная схема реализуется в природном экзотоксине Pseudomonas aeruginosa. Экзотоксин А P. aeruginosa представляет собой белок, состоящий из одной полипептидной цепи длиной в 613 аминокислот, которая организована в три функциональных домена (см. рис. II.22,б ). N-Концевой домен Ia (аминокислотные остатки 1–252) необходим для взаимодействия с поверхностью клеток-мишеней (прототип лиганда идеального лекарства направленного действия). Функции домена Ib (аминокислотные остатки 365–404) в настоящее время неизвестны. Домен II (аминокислотные остатки 253–364) обеспечивает эффективный перенос токсина в цитозоль клеток (система транспорта лекарства), а домен III (аминокислотные остатки 405–613) осуществляет ADP-рибозилирование фактора элонгации трансляции EF2, что приводит к подавлению трансляции и гибели клеток-мишеней. Таким образом, для оказания цитотоксического действия экзотоксину A необходимо с помощью домена Iа распознать рецепторы на поверхности клеток, проникнуть в клетку с помощью эндоцитоза, опосредованного рецепторами, и быть транслоцированным через внутреннюю мембрану в цитозоль, где локализуется фактор EF2. Основная идея в создании токсинов направленного действия заключалась в том, чтобы заменить домен Iа на какой-либо иной пептидный лиганд, взаимодействующий с другой группой рецепторов на поверхности клеток, и тем самым изменить специфичность действия токсина в отношении самих клеток (см. рис. II.22,в ).
Было установлено, что удаление домена Iа генно-инженерными методами резко (в сотни и тысячи раз) снижает токсичность такого укороченного белка как в отношении клеток различных линий, так и in vivo. Присоединение к С-концевой части укороченного полипептида молекулы интерлейкина 2 человека осуществляли путем объединения структурных частей соответствующих генов в экспрессирующем векторе. Очищенный гибридный токсин оказался чрезвычайно токсичным в отношении клеток, несущих на своей поверхности рецепторы интерлейкина 2, и не действовал на клетки, у которых эти рецепторы отсутствовали и которые погибали под действием природного токсина. Интернализация (транслокация внутрь клеток) гибридного токсина была опосредована субъединицами р55 и р70 рецептора интерлейкина 2. Таким образом, в результате действия гибридного токсина на популяцию клеток, часть из которых экспрессирует на своей поверхности рецепторы интерлейкина 2, происходит избирательная гибель именно этих клеток.
В организме большинство покоящихся T-клеток и T-клеток памяти не экспрессируют на своей поверхности высокоаффинных рецепторов интерлейкина 2, тогда как T-клетки, стимулированные аллоантигенами, содержат такие рецепторы. Поэтому внутрибрюшинное введение гибридного токсина крысам с экспериментальным артритом – заболеванием, обусловленным патологической активацией T-клеток, снижало симптомы заболевания. Гибридный токсин существенно уменьшал у мышей и реакции отторжения трансплантата.
Вслед за этими пионерскими работами последовала целая серия исследований, направленных на создание аналогичных систем адресной доставки различных цитотоксических полипептидов. В процессе дальнейшего усовершенствования системы адресной доставки псевдомонадного токсина с использованием интерлейкина 2 в качестве лиганда отказались от полного удаления адресного домена токсина и ограничились его инактивацией путем введения в ген токсина четырех сайт-специфических мутаций. Молекулы такого гибридного токсина оказались в 10–100 раз более эффективными цитотоксическими агентами против клеток человека и обезьян, экспрессирующих на своей поверхности рецепторы для интерлейкина 2, а также обладали значительно большим временем полужизни в крови мышей in vivo по сравнению с ранее полученной конструкцией.
На основе псевдомонадного токсина были созданы гибридные токсины, содержащие в качестве лигандов полипептидные цепи интерлейкина 4, интерлейкина 6, трансформирующего фактора роста типа и инсулиноподобного фактора роста I. Для всех этих гибридных белков была показана высокоспецифическая цитотоксичность в отношении опухолевых клеток (включая клетки миеломы человека), обладающих соответствующими рецепторами. Использование в гибридном токсине в качестве лиганда части полипептидной цепи CD4 – гликопротеина поверхности T-клеток, который является рецептором вируса ВИЧ и взаимодействует с его гликопротеином gp120, позволило избирательно поражать T-клетки, зараженные вирусом ВИЧ и экспрессирующие на своей поверхности вирусный белок gp120.
Тот же принцип подавления инфекции, вызванной вирусами ВИЧ, растворимыми рецепторами CD4 был использован при конструировании гибридных белков, объединяющих части полипептидных цепей CD4 с константными частями тяжелых или легких цепей иммуноглобулинов человека. При этом в процессе объединения генов были удалены последовательности нуклеотидов, кодирующие трансмембранный и цитоплазматический домены CD4, а также вариабельную часть полипептидных цепей иммуноглобулинов. Образующиеся гибридные молекулы, названные иммуноадгезинами , за счет константной части молекулы иммуноглобулина приобретали повышенную стабильность в организме и, кроме того, сохраняли специфические свойства, опосредуемые константными частями иммуноглобулинов: связывание Fс-рецептора и белка A, способность к фиксации комплемента и перенос через плацентарный барьер. Совокупность всех этих свойств давала возможность иммуноадгезинам эффективно прерывать инфекцию T-клеток вирусом ВИЧ-I, блокируя как сам вирус, так и зараженные им клетки, экспрессирующие на своей поверхности вирусный антиген gp120.
Дальнейшее усовершенствование генно-инженерных конструкций на основе псевдомонадного экзотоксина А произошло после того, как в качестве адресной части гибридного токсина стали использовать вариабельные домены моноклональных антител к компоненту p55 рецептора интерлейкина 2 человека. В этом рекомбинантном белке с помощью 15-звенного пептидного линкера аминокислот соединяли вариабельный домен тяжелой цепи этого иммуноглобулина с вариабельным доменом его легкой цепи, а С-конец легкой цепи – с N-концом укороченного псевдомонадного токсина (см. рис. II.22,г ). Такие молекулы гибридного токсина также оказались высокоспецифичными цитотоксическими агентами по отношению к лейкозным клеткам человека, экспрессирующим на своей поверхности рецепторы интерлейкина 2.
Разработанный подход продемонстрировал возможность использования специфических антител в качестве адресных частей гибридных токсинов. Это дает в руки исследователей универсальный способ адресной доставки токсинов, который в будущем позволит оказывать цитотоксическое действие на любые группы клеток, экспрессирующих на своей поверхности специфические антигены, т.е. значительно расширить количество мишеней для химиотерапевтических воздействий с использованием рекомбинантных белков.
Помимо псевдомонадного экзотоксина A в качестве действующего начала в гибридных токсинах успешно применяли дифтерийный токсин, фактор некроза опухолей и A-цепь рицина. Поскольку A-белок избирательно взаимодействует с константными (Fс) частями иммуноглобулинов класса G многих млекопитающих, такой гибридный токсин в паре с иммуноглобулином, полученным против какого-либо антигена на поверхности клеток, избирательно связывается с этими клетками и убивает их. Такие иммунотоксины являются еще одним потенциальным противоопухолевым агентом и могут быть использованы против клеток, экспрессирующих на своей поверхности специфические антигены.

Рис. II.23. Использование гибридного белка для регуляции экспрессии гена
Методы генной инженерии открывают безграничные возможности конструирования новых белков путем объединения в разных комбинациях различных функциональных доменов полипептидных цепей. Получение гибридных токсинов направленного действия иллюстрирует возможности такого подхода в белковой инженерии. В качестве последней иллюстрации возможностей этой группы методов рассмотрим гибридный белок как новый регулятор активности генов. При конструировании такого белка методами генной инженерии был заменен ДНК-связывающий домен в рецепторе глюкокортикоидных гормонов на соответствующий домен LexA-репрессора E. coli (рис. II.23).
Введение операторной последовательности гена lexA в область промотора глобинового гена (или других генов) приводило к активации промотора под действием гибридного белка в присутствии дексаметазона – синтетического гормона, взаимодействующего с рецептором глюкокортикоидов. Таким образом, в новом генетическом окружении последовательность нуклеотидов оператора гена lexA E. coli функционировала в качестве энхансера транскрипции в присутствии гибридного белка-активатора, узнающего эту последовательность. Результаты работы демонстрируют возможность создания новых белков – регуляторов активности генов путем комбинирования известных функциональных доменов.
Развитие белковой инженерии во многом сдерживается недостатком знания о структурно-функциональных взаимоотношениях в белках, что обусловлено сложностью объекта исследования. Многочисленные работы, направленные на изучение таких связей, как правило, носят эмпирический характер и завершаются локализацией аминокислот, существенных для функционирования активных центров ферментов. Поэтому основная задача белковой инженерии – по известной последовательности аминокислотных остатков получить белок с заданными свойствами – в настоящее время еще далека от своего разрешения. Тем не менее, уже сейчас иногда удается целенаправленно изменять некоторые свойства существующих ферментов путем замен небольшого числа аминокислотных остатков их полипептидных цепей с помощью направленного мутагенеза.
Генетическая инженерия - конструирование in vitro функционально активных генетических структур (рекомбинантных ДНК), или иначе - создание искусственных генетических программ (Баев А.А.). По Э.С. Пирузян генетическая инженерия - система экспериментальных приемов, позволяющих конструировать лабораторным путем (в пробирке) искусственные генетические структуры в виде так называемых рекомбинантных или гибридных молекул ДНК.
Генетическая инженерия - получение новых комбинаций генетического материала путем проводимых вне клетки манипуляций с молекулами нуклеиновых кислот и переноса созданных конструкций генов в живой организм, в результате которого достигается их включение и активность в этом организме и у его потомства. Речь идет о направленном, по заранее заданной программе конструировании молекулярных генетических систем вне организма с последующим введением их в живой организм. При этом рекомбинантные ДНК становятся составной частью генетического аппарата рецепиентного организма и сообщают ему новые уникальные генетические, биохимические, а затем и физиологические свойства.
Цель прикладной генетической инженерии заключается в конструировании таких рекомбинантных молекул ДНК, которые при внедрении в генетический аппарат придавали бы организму свойства, полезные для человека. Например, получение «биологических реакторов» - микроорганизмов, растений и животных, продуцирующих фармакологически значимые для человека вещества, создание сортов растений и пород животных с определёнными ценными для человека признаками. Методы генной инженерии позволяют провести генетическую паспортизацию, диагностировать генетические заболевания, создавать ДНК-вакцины, проводить генотерапию различных заболеваний .
Технология рекомбинантных ДНК использует следующие методы:
Специфическое расщепление ДНК рестрицирующими нуклеазами, ускоряющее выделение и манипуляции с отдельными генами;
Быстрое секвенирование всех нуклеотидов очищенном фрагменте ДНК, что позволяет определить границы гена и аминокислотную последовательность, кодируемую им;
Конструирование рекомбинантной ДНК;
Гибридизация нуклеиновых кислот, позволяющая выявлять специфические последовательности РНК или ДНК с большей точностью и чувствительностью, основанную на их способности связывать комплементарные последовательности нуклеиновых кислот;
Клонирование ДНК: амплификация in vitro с помощью цепной полимеразной реакции или введение фрагмента ДНК в бактериальную клетку, которая после такой трансформации воспроизводит этот фрагмент в миллионах копий;
Введение рекомбинантной ДНК в клетки или организмы.
Конструирование рекомбинантных молекул осуществляется с помощью ряда ферментов – прежде всего ферментов рестрикции. В настоящее время используется свыше 400 различных рестриктаз. Эти ферменты синтезируют самые разнообразные микроорганизмы .
Рестриктазы узнают и расщепляют специфические нуклеотидные последовательности в двухцепочечной молекуле ДНК. Однако одних ферментов рестрикции при молекулярном клонировании недостаточно, так как водородные связи между четырьмя основаниями, которые образуют липкие концы, не столь прочны, чтобы удержать два объединившихся фрагмента ДНК.
Одна часть рекомбинантной молекулы ДНК несет нужный ген, который предполагается клонировать, другая – содержит информацию, необходимую для репликации в клетке рекомбинантной ДНК.
Естественный отбор - движущая сила эволюции
Естественный отбор - это процесс, направленный на предпочтительное выживание более приспособленных и уничтожение менее приспособленных организмов. Более приспособленные особи имеют возможность оставить потомство. Материалом для отбора слу...
Выявление возбудителей брожения пектиновых веществ
Постановка опыта.
Снопик льняной соломы высотой 6-7 см перевязывают в двух местах ниткой и вносят в пробирку лучше большего, чем стандартный, размера, наполненную на 2/3 водопроводной водой. Пробирку зажимают пинцетом и кипятят на горелк...
Переход от биосферы к ноосфере
Превращение разума и труда человечества в геологическую силу планетного масштаба происходило в рамках биосферы, составной частью которой они являются. В.И. Вернадский в своих исследованиях неизменно подчёркивал, какое огромное воздействие...